) ، وكذلك في كيمياء المركبات المعقدة، للدلالة على الجسيمات المرتبطة بواحدة أو أكثر من ذرات المعدن المركزية (المكونة للمعقدة).
في الكيمياء غير العضوية
في أغلب الأحيان، يحدث هذا الارتباط مع تكوين ما يسمى برابطة المانحين والمستقبلين "التنسيق"، حيث تعمل الروابط كقاعدة لويس، أي أنها مانحة لزوج الإلكترون. عندما ترتبط الروابط بالذرة المركزية الخواص الكيميائيةغالبًا ما يخضع العامل المعقد والروابط نفسها لتغييرات كبيرة.
تسميات يجند
- الأول في اسم الاتصال في حالة اسميةيسمى أنيونًا، ثم في المضاف إليه - كاتيون
- يسرد اسم الأيون المعقد أولاً الروابط الموجودة فيه ترتيب ابجديثم الذرة المركزية
- تسمى الذرة المركزية في المجمعات الكاتيونية المحايدة بالاسم الروسي، وفي الأنيونات بالجذر الاسم اللاتينيمع اللاحقة "في". وبعد اسم الذرة المركزية يشار إلى حالة الأكسدة.
- تتم الإشارة إلى عدد الروابط المرتبطة بالذرة المركزية بالبادئات "أحادي"، "di"، "ثلاثي"، "رباعي"، "بنتا"، إلخ.
خصائص الروابط
الهيكل الإلكتروني
في الواقع، فإن أهم ما يميز الليجند، والذي يسمح لنا بتقييم والتنبؤ بقدرته على تكوين مجمعات والتدمير الذاتي للمدار D، هو تدمير المركب ككل. كتقريب أولي، فإنه يتضمن عدد أزواج الإلكترونات التي يستطيع الربيط تخصيصها لإنشاء روابط التنسيق والسالبية الكهربية للذرة المانحة أو المجموعة الوظيفية.
طب الأسنان
يُطلق على عدد مواقع التنسيق للذرة المركزية (أو الذرات) التي تشغلها اللجند اسم dentacy (من اللاتينية. أوكار، دنت- - الأسنان). يتم استدعاء الروابط التي تشغل نفس موقع التنسيق كثرة الوحيداتمسنن (على سبيل المثال، نح 3)، اثنان - ثنائيةمسنن (أنيون الأكسالات [ يا-C(=O)-C(=O) -O] 2−). عادةً ما يتم تصنيف الروابط التي يمكن أن تشغل عددًا أكبر من المواقع على أنها بوليمسنن. على سبيل المثال، حمض الإيثيلين ثنائي أمين رباعي الأسيتيك (EDTA)، والذي يمكن أن يشغل ستة مواقع تنسيق.
بالإضافة إلى الأسنان، هناك خاصية تعكس عدد ذرات الليجند المرتبطة بموقع تنسيق واحد للذرة المركزية. في الأدب الإنجليزي يشار إليه بالكلمة السعادةولها تسمية تسمية مع مرتفع المقابلة. على الرغم من أنه لا يوجد على ما يبدو مصطلح ثابت في اللغة الروسية، إلا أنه في بعض المصادر يمكنك العثور على ورقة البحث عن المفقودين "haptnost". كمثال، يمكننا أن نستشهد بروابط سيكلوبنتاديينيل في مجمعات معدنية مركزية، تشغل موقع تنسيق واحد (أي كونها أحادية السن) ومتصلة من خلال ذرات الكربون الخمس: η 5 - − .
طرق التنسيق
 الروابط التي لها قوة أكبر من اثنين قادرة على التشكل مجمعات شيلات(اليونانية χηλή
- مخلب) - مجمعات حيث يتم تضمين الذرة المركزية في دورة واحدة أو أكثر مع جزيء يجند. تسمى هذه الروابط خالب. على سبيل المثال، يمكننا أن نستشهد بمجمعات رباعي الأنيون لنفس EDTA، مع ملاحظة أن العديد من روابط M-O الأربعة الموجودة فيه يمكن أن تكون رسميًا أيوني .
الروابط التي لها قوة أكبر من اثنين قادرة على التشكل مجمعات شيلات(اليونانية χηλή
- مخلب) - مجمعات حيث يتم تضمين الذرة المركزية في دورة واحدة أو أكثر مع جزيء يجند. تسمى هذه الروابط خالب. على سبيل المثال، يمكننا أن نستشهد بمجمعات رباعي الأنيون لنفس EDTA، مع ملاحظة أن العديد من روابط M-O الأربعة الموجودة فيه يمكن أن تكون رسميًا أيوني .
عندما يتم تشكيل مجمعات مخلبية، غالبا ما يتم ملاحظتها تأثير عملية إزالة معدن ثقيل- ثباتها الأكبر مقارنة بالمجمعات المماثلة من الروابط غير المخلبية. يتم تحقيق ذلك بسبب الحماية الأكبر للذرة المركزية من التأثيرات البديلة وتأثير الإنتروبيا. على سبيل المثال، ثابت التفكك لمجمع الأمونيا من الكادميوم 2+ أقل بحوالي 1500 مرة من ثابت التفكك مع الإيثيلينديامين 2+. والسبب في ذلك هو أنه عندما يتفاعل أيون الكادميوم (II) المائي مع الإيثيلينديامين، فإن جزيئين من الربيطة يحلان محل أربعة جزيئات ماء. في هذه الحالة، يزداد عدد الجسيمات الحرة في النظام بشكل ملحوظ، وتزداد إنتروبيا النظام (ويزداد الترتيب الداخلي للمعقد تبعًا لذلك). وهذا يعني أن سبب تأثير المخلب هو زيادة إنتروبيا النظام عندما يتم استبدال الروابط أحادية السن برباطات متعددة الأسنان، ونتيجة لذلك، انخفاض في طاقة جيبس.
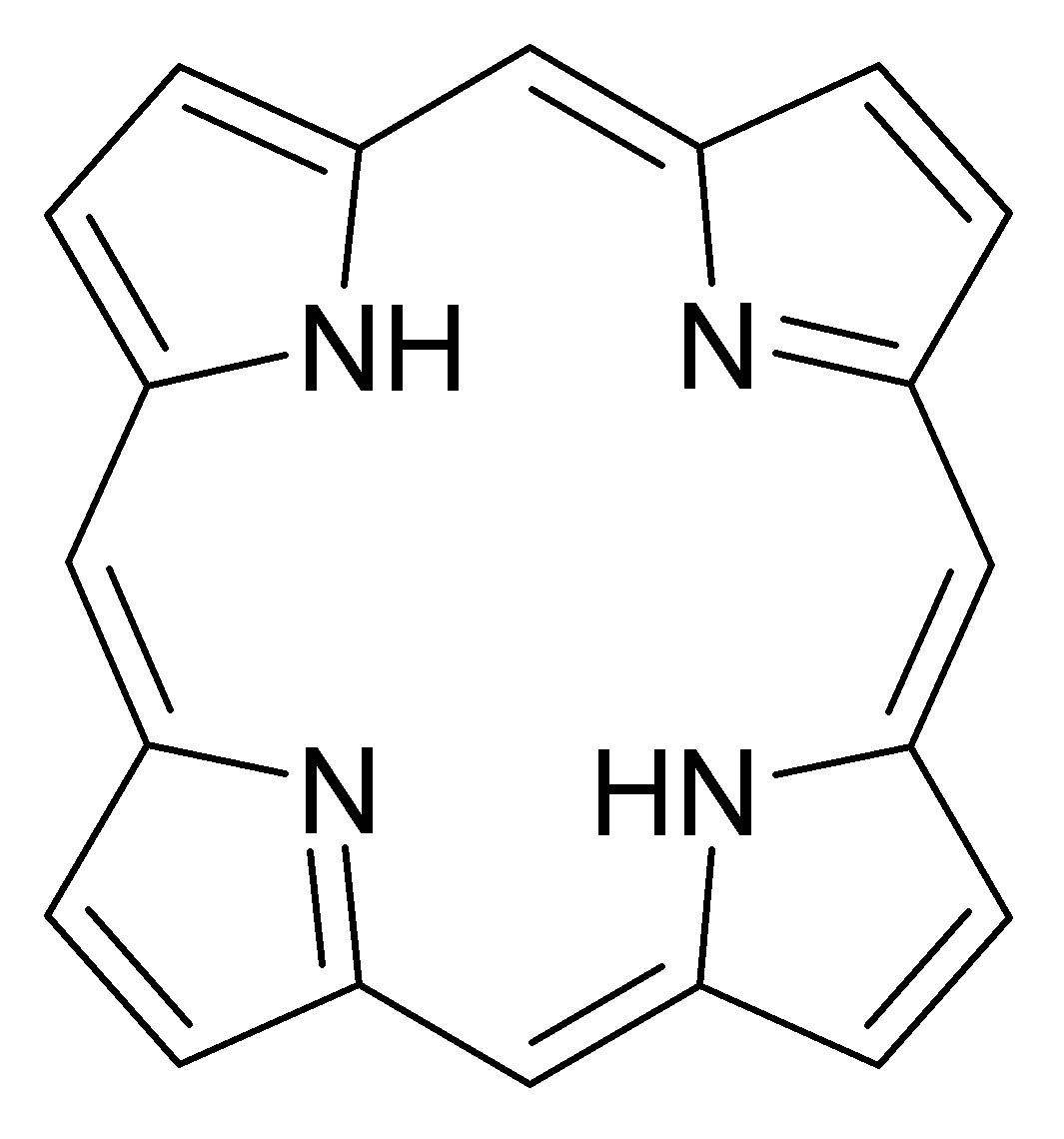 من بين الروابط المخلبية، يمكن للمرء أن يميز فئة من الروابط الحلقية الكبيرة - وهي جزيئات ذات مساحة داخل الحلقة كافية لاستيعاب الذرة المعقدة. ومن الأمثلة على هذه المركبات قواعد البورفيرين - وهي أساس أهم المجمعات الكيميائية الحيوية، مثل الهيموجلوبين والكلوروفيل والبكتريوكلوروفيل. يمكن أيضًا أن تعمل إثيرات التاج والكالكسارينات وما إلى ذلك كروابط كبيرة الحلقات.
من بين الروابط المخلبية، يمكن للمرء أن يميز فئة من الروابط الحلقية الكبيرة - وهي جزيئات ذات مساحة داخل الحلقة كافية لاستيعاب الذرة المعقدة. ومن الأمثلة على هذه المركبات قواعد البورفيرين - وهي أساس أهم المجمعات الكيميائية الحيوية، مثل الهيموجلوبين والكلوروفيل والبكتريوكلوروفيل. يمكن أيضًا أن تعمل إثيرات التاج والكالكسارينات وما إلى ذلك كروابط كبيرة الحلقات.
يمكن أيضًا أن تكون الروابط بمثابة جسور، وتشكل روابط بين الذرات المركزية المختلفة في المجمعات ثنائية أو متعددة النوى. يتم تحديد روابط الجسور بالحرف اليوناني μ ( مو).
اكتب رأيك عن مقالة "ليغاند"
ملحوظات
|
||||||||||||||||||
مقتطف يميز يجند
وقال: "إذا قاتل الجميع وفقًا لقناعاتهم فقط، فلن تكون هناك حرب".قال بيير: "سيكون ذلك رائعًا".
ابتسم الأمير أندريه.
- قد يكون الأمر رائعًا، لكنه لن يحدث أبدًا..
- حسنا، لماذا أنت ذاهب للحرب؟ - سأل بيير.
- لماذا؟ لا أعرف. هذا هو ما ينبغي أن يكون. علاوة على ذلك، أنا ذاهب..." توقف. "سأرحل لأن هذه الحياة التي أعيشها هنا، هذه الحياة ليست لي!"
ارتجف فستان امرأة في الغرفة المجاورة. كما لو كان يستيقظ، اهتز الأمير أندريه، واتخذ وجهه نفس التعبير الذي كان عليه في غرفة معيشة آنا بافلوفنا. أرجح بيير ساقيه من على الأريكة. دخلت الأميرة. لقد كانت ترتدي بالفعل فستانًا منزليًا مختلفًا ولكنه أنيق وجديد بنفس القدر. وقف الأمير أندريه وحرك لها كرسيًا بأدب.
"لماذا، أعتقد في كثير من الأحيان،" تحدثت، كما هو الحال دائمًا، بالفرنسية، وهي تجلس على كرسي على عجل وبقلق، "لماذا لم تتزوج أنيت؟" كم أنتم أغبياء أيها السادة لعدم الزواج منها. عذرا، لكنك لا تفهم شيئا عن النساء. كم أنت مجادل يا سيد بيير.
«أنا أيضًا أتجادل مع زوجك؛ "لا أفهم لماذا يريد خوض الحرب"، قال بيير دون أي إحراج (شائع جدًا في العلاقات). شابلامرأة شابة) مخاطبة الأميرة.
الأميرة انتعشت. من الواضح أن كلمات بيير أثرت في قلبها.
- أوه، هذا ما أقوله! - قالت. "أنا لا أفهم، أنا لا أفهم على الإطلاق، لماذا لا يستطيع الرجال العيش بدون حرب؟ لماذا نحن النساء لا نريد أي شيء، لا نحتاج إلى أي شيء؟ حسنا، أنت القاضي. أقول له كل شيء: ها هو مساعد عمه، وهو المنصب الأكثر روعة. الجميع يعرفه كثيرًا ويقدره كثيرًا. ذات يوم في منزل عائلة أبراكسين سمعت سيدة تسأل: "هل هو الأمير أندريه المشهور؟" يا له من شرف! [هل هذا هو الأمير أندريه الشهير؟ بصراحة!] – ضحكت. - إنه مقبول جدًا في كل مكان. يمكن أن يكون بسهولة مساعدًا في الجناح. كما تعلمون، تحدث الملك معه بلطف شديد. تحدثت أنا وأنيت عن مدى سهولة ترتيب ذلك. كيف تفكر؟
نظر بيير إلى الأمير أندريه، ولاحظ أن صديقه لم يعجبه هذه المحادثة، لم يجيب.
- متى ستغادر؟ - سأل.
- آه! تحدثت الأميرة في حديثها: "لا تتحدث معي عن هذا الرحيل، لا تتحدث معي عن هذا الرحيل، لا أريد أن أسمع عنه". مثل هذه النغمة المرحة المتقلبة، كما لو كانت تتحدث إلى هيبوليت في غرفة المعيشة، والتي من الواضح أنها لم تذهب إلى دائرة العائلة، حيث كان بيير عضوًا فيها - اليوم، عندما اعتقدت أنني بحاجة إلى قطع كل شيء هذه العلاقات العزيزة... وبعد ذلك، كما تعلم يا أندريه، نظرت إلى زوجها بشكل ملحوظ: "J"ai peur، j"ai peur! [أنا خائفة، أنا خائفة!] همست وهي تهز ظهرها .
نظر إليها الزوج وكأنه فوجئ بملاحظة وجود شخص آخر بجانبه وبيير في الغرفة؛ والتفت إلى زوجته بأدب بارد:
- ما الذي تخافين منه يا ليزا؟ قال: "لا أستطيع أن أفهم".
– هكذا كل الرجال أنانيون؛ الجميع، الجميع أناني! بسبب أهوائه، الله وحده يعلم السبب، تخلى عني، حبسني في القرية وحدي.
قال الأمير أندريه بهدوء: "لا تنسَ مع والدك وأختك".
- لا أزال وحدي بدون أصدقائي... ويريدني ألا أخاف.
كانت لهجتها متذمرة بالفعل، وشفتها مرفوعة، مما لم يمنح وجهها تعبيرًا بهيجًا، بل تعبيرًا وحشيًا يشبه السنجاب. صمتت وكأنها وجدت أنه من غير اللائق التحدث عن حملها أمام بيير، عندما كان هذا هو جوهر الأمر.
"ما زلت، أنا لا أفهم، de quoi vous avez peur، [ما الذي تخاف منه،" قال الأمير أندريه ببطء، دون أن يرفع عينيه عن زوجته.
احمرت الأميرة خجلاً ولوحت بيديها بيأس.
- لا، أندريه، je dis que vous avez Tellement، Tellement Change... [لا، أندريه، أنا أقول: لقد تغيرت كثيرًا، لذا...]
قال الأمير أندريه: "طبيبك يخبرك أن تذهب إلى الفراش مبكرًا". - يجب أن تذهب إلى السرير.
لم تقل الأميرة شيئًا، وفجأة بدأت إسفنجتها القصيرة ترتعش؛ وقف الأمير أندريه وهز كتفيه وتجول في الغرفة.
نظر بيير من خلال نظارته بمفاجأة وسذاجة إليه أولاً، ثم إلى الأميرة، وتحرك، كما لو كان يريد النهوض أيضًا، لكنه فكر في الأمر مرة أخرى.
قالت الأميرة الصغيرة فجأة: "ما الذي يهمني أن يكون السيد بيير هنا؟"، وتحول وجهها الجميل فجأة إلى تكشيرة دامعة. "كنت أريد أن أخبرك منذ فترة طويلة يا أندريه: لماذا تغيرت تجاهي كثيرًا؟" ماذا فعلت لك؟ أنت ذاهب إلى الجيش، أنت لا تشعر بالأسف بالنسبة لي. لماذا؟
- ليز! - الأمير أندريه قال للتو؛ ولكن في هذه الكلمة كان هناك طلب وتهديد، والأهم من ذلك، التأكيد على أنها ستتوب من كلماتها؛ لكنها تابعت على عجل:
"أنت تعاملني وكأنني مريض أو كطفل." أرى كل شيء. هل كنت هكذا منذ ستة أشهر؟
قال الأمير أندريه بشكل أكثر وضوحًا: "ليز، أطلب منك التوقف".
بيير، الذي أصبح مضطربًا أكثر فأكثر خلال هذه المحادثة، وقف واقترب من الأميرة. وبدا أنه غير قادر على تحمل منظر الدموع وكان مستعدًا للبكاء بنفسه.
- اهدأي يا أميرة. يبدو الأمر هكذا بالنسبة لك، لأنني أؤكد لك، لقد جربت بنفسي... لماذا... لأن... لا، عفواً، الغريب لا لزوم له هنا... لا، اهدأ... إلى اللقاء...
أوقفه الأمير أندريه من يده.
- لا، انتظر، بيير. الأميرة لطيفة جدًا لدرجة أنها لن تريد أن تحرمني من متعة قضاء المساء معك.
قالت الأميرة وهي غير قادرة على حبس دموعها الغاضبة: "لا، إنه لا يفكر إلا في نفسه".
"ليز"، قال الأمير أندريه بجفاف، ورفع لهجته إلى درجة تظهر استنفاد الصبر.
وفجأة، تم استبدال التعبير الغاضب الشبيه بالسنجاب لوجه الأميرة الجميل بتعبير خوف جذاب ومثير للرحمة؛ نظرت من تحت عينيها الجميلتين إلى زوجها، وظهر على وجهها ذلك التعبير الخجول والمعترف الذي يظهر على كلب، يلوح بسرعة ولكن بضعف بذيله المنخفض.
الموضوع: نقل الغشاء
المستقبلات داخل الخلايا: https://www.youtube.com/watch?v=Nm9u4lNCPyM
مستقبلات الغشاء الأيضي المرتبطة بنظام الرسول الثاني: https://www.youtube.com/watch?v=dQ4yVuLAbH0
مستقبلات الغشاء الأيضي المرتبطة بنشاط التيروزين كيناز:
أنواع النقل عبر الغشاء.
أنواع قنوات النقل عبر الغشاء.
مفهوم المواد القطبية وغير القطبية.
تحافظ النفاذية الانتقائية عبر الغشاء على التوازن الخلوي، والمحتوى الأمثل للأيونات والماء والإنزيمات والركائز في الخلية. طرق تحقيق نفاذية الغشاء الانتقائية: النقل السلبي، النقل المحفز (الانتشار الميسر)، النقل النشط. تحدد الطبيعة الكارهة للماء للنواة ثنائية الطبقة إمكانية (أو استحالة) الاختراق المباشر لمواد مختلفة من وجهة نظر فيزيائية وكيميائية (قطبية وغير قطبية في المقام الأول) عبر الغشاء.
المواد غير القطبية(على سبيل المثال، الكوليسترول ومشتقاته) تخترق الأغشية البيولوجية بحرية. لهذا السبب، يتم الالتقام الخلوي وإخراج المركبات القطبية (على سبيل المثال. هرمونات الببتيد) تحدث بمساعدة الحويصلات الغشائية، ويحدث إفراز الهرمونات الستيرويدية دون مشاركة هذه الحويصلات. لنفس السبب، توجد مستقبلات للجزيئات غير القطبية (على سبيل المثال، هرمونات الستيرويد) داخل الخلية.
المواد القطبية(مثل البروتينات والأيونات) لا يمكنها اختراق الأغشية البيولوجية. ولهذا السبب يتم بناء مستقبلات الجزيئات القطبية (على سبيل المثال، هرمونات الببتيد) في غشاء البلازما، ويقوم المرسل الثاني بنقل الإشارات إلى الأجزاء الخلوية الأخرى. لنفس السبب، يتم نقل المركبات القطبية عبر الغشاء بواسطة أنظمة خاصة مدمجة في الأغشية البيولوجية.
يتم توفير النفاذية الانتقائية بواسطة غشاء الخلية. يتم تحقيق وظيفة المستقبل عن طريق البروتينات السكرية، التي توجد أجزاء الكربوهيدرات منها في الكأس السكري، ويتم ضمان الاحتفاظ بالشكل والتنقل بواسطة البروتينات الليفية والأنبوبية في الطبقة تحت الغشاء، وما إلى ذلك.
مفهوم المستقبل و يجند
مستقبل الخلية- جزيء موجود على سطح الخلية أو النواة أو العضيات الخلوية أو مذاب في السيتوبلازم. يتفاعل المستقبل الخلوي على وجه التحديد عن طريق تغيير تكوينه المكاني (شكله) لارتباط جزيء مادة كيميائية معينة به - يجند، يحيل إشارة تنظيمية خارجية. وهذا بدوره ينقل هذه الإشارة إلى الخلية أو عضية الخلية. المكان على المستقبل حيث تعلق يجند يسمى الموقع.يمكن أن يحتوي نفس المستقبل على عدة مواقع. يمكن تقسيم المستقبلات الخلوية إلى فئتين رئيسيتين - مستقبلات الغشاء (تقع على الغشاء الذي يفصل الخلية عن بيئة خارجية) و المستقبلات داخل الخلايا.
تسمى المادة التي ترتبط على وجه التحديد بمستقبل ما يجند (عن طريق رسول) هذا المستقبل. وهكذا، فإن يجند (مرادف: رسول) هو مادة كيميائية، قادرة على التفاعل مع المستقبل. قد تختلف نتيجة هذا التفاعل. إذا كان الليجند (الرسول) يؤدي إلى تغير في الشكل المستقبل وتنشيطه يسمى ناهض . إذا قام المركب (الرسول) بتغيير شكل (التشكل) للمستقبل و منع هذا المستقبل ويسمى خصم.
متى نحن نتحدث عنفيما يتعلق بأعضاء الحواس، فإن الروابط (الرسل) هي مواد تعمل على مستقبلات الشم أو التذوق.
هناك أيضًا بروتينات مستقبلات حساسة للحرارة وبروتينات مستقبلات تستجيب للتغيرات في إمكانات الغشاء.
توجد مستقبلات الروابط القابلة للذوبان في الماء (المرسلين) - هرمونات البروتين، الأدرينالين، النورإبينفرين - على سطح الغشاء (مستقبلات الغشاء)، ويرجع ذلك إلى حقيقة أن الروابط المحبة للماء لا يمكنها المرور عبر السطح الكاره للماء للغشاء. تمر الروابط (الرسل) القابلة للذوبان في الدهون بسهولة عبر طبقة ثنائية الفسفوليبيد لغشاء الخلية والنواة، وبالتالي تحدد الخلية مستقبلاتها (المستقبلات داخل الخلايا) بالداخل: على العضيات، النواة. ومن أمثلة الروابط القابلة للذوبان في الدهون هرمونات الستيرويدالغدد الكظرية، الغدد التناسلية.
وبالإضافة إلى ذلك، يمكن فصل الروابط إلى خارجية(قادم من الخارج) و ذاتية النمو(تتشكل داخل الجسم). كقاعدة عامة، إذا كانت بعض المواد الخارجية لها مستقبلات على الخلايا، فإن الجسم لديه أيضًا روابط داخلية لهذا المستقبل. على سبيل المثال، الليجند الداخلي لمستقبلات القنب التي ترتبط بها قلويدات القنب هي مادة أنانداميد، التي ينتجها الجسم من حمض الأراكيدونيك. حمض دهني. أو مستقبلات الإندورفين (play دور مهمفي تشكيل الألم و الحالة العاطفية): يمكن أن يرتبط بروابط داخلية - الإندورفين، أو يمكن أن يرتبط بأدوية مجموعة المورفين.
أو المتطرفين المرتبطين بالمركز. ذرة مركب معقد . قد يفعلون ذلك. الأيونات (H - , Hal - , NO 3 - , NCS - إلخ)، inorg. الجزيئات (H 2، C n، N 2، P n، O 2، Sn، CO، CO 2، NH 3، NO، SO 2، NO 2، COS، إلخ)، org. مركبات تحتوي على عناصر المجموعات الفرعية الرئيسية V، VI، VII gr. دورية الأنظمة أو وظيفة المانح. مجموعة كبيرة من مركبات L. ذات الأهمية البيولوجية. (، الببتيدات، البيورينات، الكورينات،) والمواد التركيبية الخاصة بها. نظائرها (إيثرات التاج،) وكذلك مع الذرات المانحة والمجموعات المخلبية. L. يمكن توصيله بالمركز. ذرة ذات روابط s- وp- وd ثنائية المركز أو متعددة المراكز. في حالة تكوين روابط ثنائية المركز في الألومنيوم، يمكن تحديد المراكز المانحة (عادة N، O، S، Cl، أو الذرات). يتم تنفيذ الربط متعدد المراكز بسبب نظام p العطري. L. (، أنيون سيكلوبنتاديينيد) أو غير متجانسة. L. (، الثيوفين، ميثيلبيريدين). الكمية الأكثر أهمية. من سمات قدرة الرباط المانح والمتقبل هو التسنن، الذي يحدده عدد مراكز المتبرع للرباط المشاركة في التنسيق. على هذا الأساس، يتم تقسيم L. إلى أحادي، ثنائي، ... متعدد الأسنان. التنسيق. يتطابق عدد العامل المعقد للأربطة أحادية السن مع عددها، وبالنسبة للآخرين فهو يساوي ناتج عدد الأربطة وأسنانها. طبيعة L. تحدد أنواع التنسيق. كون. (، المجمعات الأمينية، المقارنات الجزيئية، المخلبيات، المجمعات p، وما إلى ذلك)؛ تعتمد الخصائص والبنية والتفاعل عليها. قدرة الاتصالات المعقدة وإمكانية تطبيقها العملي التطبيقات. أشعل.: Garnevsky A.D.، "إزفستيا. مؤسسات التعليم العالي، سلسلة. الكيمياء والتكنولوجيا الكيميائية." 1987، المجلد 30، ق. 10، ص. 3-16؛ "التنسيق."، 1988، المجلد 14، ج. 5، ص. 579-99؛ الكيمياء التنسيقية الشاملة، v. 2-ليغاندز، أوكسف، 1987. أ.د جارنوفسكي.
الموسوعة الكيميائية. - م: الموسوعة السوفيتية. إد. I. L. كنونيانتس. 1988 .
انظر ما هي "LIGANS" في القواميس الأخرى:
- (من اللاتينية ليغو I bind) في المركبات المعقدة أو الجزيئات أو الأيونات المرتبطة بالذرة المركزية (عامل معقد) على سبيل المثال. في اتصال LIGATURE (اتصال ligatura المتأخر) 1) حرف أو علامة النسخ الصوتي المكونة من ... ... كبير القاموس الموسوعي
بروابط- (يضيف) - الأيونات أو الجذور أو الجزيئات المحايدة الموجودة حول الأيون المركزي (الذرة) نتيجة تكوين رابطة التنسيق. الكيمياء العامة: كتاب مدرسي / A. V. Zholnin ... المصطلحات الكيميائية
- (من اللاتينية ligo I bind)، في المركبات المعقدة توجد جزيئات أو أيونات مرتبطة بذرة مركزية (عامل معقد)، على سبيل المثال، في مركب Cl3 توجد ذرة Co مركزية، والروابط هي جزيئات NH3. * * * ليجاندس ليجاندس (من اللاتينية ليجو ... القاموس الموسوعي
- (من الليغو اللاتيني أنا أربط) في المركبات المعقدة (انظر المركبات المعقدة) الجزيئات أو الأيونات المرتبطة مباشرة بالذرة المركزية؛ نفس الاضافات... الموسوعة السوفيتية الكبرى
- (من Lat. ligo I Connect)، في حاويات معقدة. جزيئات أو أيونات مرتبطة بمركز، ذرة (عامل معقد)، على سبيل المثال. في اتصال [Co(NH3)6] مركز C13. ذرة ثاني أكسيد الكربون، وجزيء L. NH3... علم الطبيعة. القاموس الموسوعي
- ... ويكيبيديا
الروابط- (ليغو اللاتينية – أنا أربط). مواد داخلية محددة تثير أنواعًا معينة من مستقبلات الدماغ الخلوية - الأدرينالية، الدوبامين، الكوليني، السيروتونين، البنزوديازيبين، الببتيدرج، إلخ. القاموس التوضيحي للمصطلحات النفسية
بروابط- ليغ الأنديز، أوف، الوحدات. ح.و، و... قاموس التهجئة الروسية
الروابط- (lat. ligo bind) مواد داخلية تمثل ناقلات عصبية في نقاط الاشتباك العصبي في الدماغ (الدوبامين، الأسيتيل كولين، السيروتونين، إلخ). عقار ذات التأثيرالنفسيوالمهلوسات لها أيضًا بعض خصائص الروابط. * * * بيولوجيا … … القاموس الموسوعي لعلم النفس والتربية
بروابط محورية- الحالات المرتبطة بـ T sritis chemija apibrėžtis Vienoje asyje ligandai. السمات: الإنجليزية. بروابط محورية روس. الروابط المحورية ryšiai: sinonimas – aksialiniai ligandai ... الكيمياء تنتهي بالبقاء على قيد الحياة
كتب
- المشاكل المناعية لموت الخلايا المبرمج، أ. يو باريشنيكوف، ف. شيشكين. تميز العقد الماضي بالدراسة السريعة لعملية موت الخلايا المبرمج (موت الخلايا المبرمج). تم اكتشاف مستقبلات سطح الخلية وروابطها التي تتوسط ...
الروابط - هذه هي المواد التي يمكن أن ترتبط بشكل خاص بالمركز النشط للجزيئات ذات بنية معينة.
Bioligands أقترح تسمية تلك الروابط التي تقوم بالتنظيم الحيوي في الكائنات الحية بسبب ارتباطها بجزيئات المستقبلات المستهدفة. (© Sazonov V.F.، 2012. © kineziolog.bodhy.ru، 2012.)
الروابط في التنظيم الحيوي (الروابط الحيوية) - هذه في الواقع عبارة عن مواد تحكم إشارات قادرة على إرسال أوامر التحكم بسبب ارتباطها بالمركز النشط للمستقبلات الجزيئية التي لها خصوصية.
وهكذا يمكننا أن نقول ذلك بالضبط bioligandsتنفيذ التنظيم الكيميائي ، أي. السيطرة الكيميائية على الخلايا أو الكائن الحي أو أجزائه أو مجموعة من الكائنات الحية.
آلية عمل المركب الحيوي
بناءً على تأثير الروابط على تكوين البروتين، يمكن تقسيم تفاعلات البروتين إلى عدة فئات.
تفاعلات الفئة الأولى:
عندما يرتبط المركب بالبروتين، فإنه لا يسبب تغيرات كبيرة في التشكل، ولكنه يعمل على تثبيت بنية البروتين.
مثال على ذلك هو ارتباط أيونات Ca2* بالليزوزيم. في وجود يجند (Ca2")، تكون هناك حاجة إلى تركيزات كبيرة من العامل المقابل (اليوريا أو هيدروكلوريد الجوانيدين) لإفساد الليزوزيم.
على ما يبدو، في هذه الحالة، بمساعدة Ca2< образуются дополнительные связи между радикалами.
تفاعلات الدرجة الثانية:
يغير المركب بشكل كبير البنية الثلاثية للبروتين، وفقط في هذه الحالة يصبح البروتين نشطًا بدرجة كافية.
مثال - ربط أيونات Ca2* بالهيمودولين - مستقبلات داخل الخلاياهذه الأيونات. من خلال ربط أيوني Ca2*، يكتسب الكالموديولين القدرة على التأثير على نشاط العديد من بروتينات الخلايا.
تفاعلات الدرجة الثالثة:
في حالة عدم وجود يجند، البروتين في ما يسمى. حالة الكرة المنصهرة: لها شكل كروي مدمج إلى حد ما، ولكن بدون أي بنية ثلاثية محددة - تتشكل الأخيرة فقط عند ربط اللجند.
مثال على هذا البروتين هو اللاكتالبومين (أحد مكونات مجمع الإنزيم لتخليق اللاكتوز). هذا بروتين صغير يحتوي على 4 روابط ثاني كبريتيد ويرتبط بإحكام بـ 1 Ca* ion. على ما يبدو، هذا الأيون هو عنصر أساسي في تشكيل البنية. عند إزالته، يتم تدمير البنية الثلاثية للبروتين. ولكن يتم الحفاظ على الشكل الكروي وحجم الكرة الكروية بسبب التأثير المثبت لروابط ثاني كبريتيد.
تفاعلات الدرجة الرابعة:
بدون الربيطة، لا يتشكل الهيكل الثانوي للبروتين بشكل كامل ويكون هيكله الثالث غائبًا تمامًا. في هذه الحالة، يتم الكشف عن سلسلة الببتيد جزئيا.
مثال على البروتين هو أوستيوكالسين، الموجود في مصفوفة العظام. يحتوي فقط على حوالي 50 من بقايا الأحماض الأمينية وهو قادر على ربط 5 أيونات Ca." ويصاحب الارتباط انخفاض كبير في حجم الكريات، وتشكيل بنية ثلاثية ودمج الكريات في ثنائيات. في هذه الحالة، يكون المركب ضروريًا لظهور البنية الرباعية في البروتين.
تفاعلات الفئة الخامسة:
في حالة عدم وجود يجند، يتم الكشف عن سلسلة البروتين بالكامل تقريبا، أي أنها عبارة عن ملف عشوائي. التفاعل مع يجند يؤدي إلى التكوين الكامل للبنية المكانية للبروتين.
ومن الأمثلة على ذلك السيتوكروم ج، وهو أحد بروتينات سلسلة نقل الإلكترون في الميتوكوندريا. ربيطه هو الهيم (يشبه الهيموجلوبين). تؤدي إزالة السمة إلى الكشف الكامل تقريبًا عن جزيء البروتين.
تفاعلات الفئة السادسة:
يؤدي ربط Ligand إلى تحركات واسعة النطاق لنطاقات البروتين أو الوحدات الفرعية.
ومن الأمثلة على ذلك تفاعل الهيموجلوبين (Hb) مع الأكسجين. خلال هذه العملية، تحدث تحولات تكوينية عديدة ومعقدة. بما في ذلك الوحدات الفرعية المجاورة تدور بالنسبة لبعضها البعض بمقدار 10 15 بوصة.
ونتيجة لذلك، عندما يرتبط جزيء 02 بهيم وحدة فرعية واحدة، فإن تقارب الأكسجين للوحدات الفرعية المجاورة يزداد. ويشار إلى هذا باسم التأثير التعاوني وله أهمية فسيولوجية كبيرة.
وفي ختام هذه الفقرة نتقدم بملاحظتين:
أ) أولاً، كما يمكن أن نرى، يمكن للروابط أن تؤثر بشكل كبير جدًا على تكوين البروتين؛
ب) ثانيًا، بالنسبة للبروتين الذي يحتوي على عدة بروابط (خاصة إذا كانت الأخيرة مرتبطة بـ في أجزاء مختلفةالجزيئات)، فإن طبيعة مثل هذا التأثير يمكن أن تكون مختلفة تمامًا بالنسبة للروابط المختلفة.
على سبيل المثال، الروابط مثل الهيم والأكسجين لها تأثيرات مختلفة على بنية الهيموجلوبين.
لذلك، على عكس مؤلفي التنظيم المقدم هنا (V. N. Uversky و N. V. Narizhneva)، لم نتحدث عن فئات البروتينات، ولكن عن فئات تفاعلات البروتين.
Ppt%5C34928-slozhnye_belki_ch1_1.jpg" alt="> مركز نشطالبروتين وتفاعله مع الليكاند. أثناء تكوين البنية الثلاثية "> المركز النشط للبروتين وتفاعله مع الليجند. في عملية تكوين البنية الثلاثية على سطح البروتين النشط وظيفيًا، عادة في فترة راحة، تتشكل منطقة تتكون من جذور الأحماض الأمينية التي تكون متباعدة عن بعضها البعض الهيكل الأساسي. هذه المنطقة، التي لديها بنية فريدة لبروتين معين وقادرة على التفاعل بشكل خاص مع جزيء معين أو مجموعة من الجزيئات المماثلة، تسمى موقع ربط البروتين ليجند أو الموقع النشط. الروابط هي جزيئات تتفاعل مع البروتينات.
Ppt%5C34928-slozhnye_belki_ch1_2.jpg" alt=">يمكن أن تكون الربيطة إما مادة ذات وزن جزيئي منخفض أو مادة ذات وزن جزيئي مرتفع (جزيء كبير)، بما في ذلك"> Лигандом может быть как низкомолекулярное, так и высокомолекулярное (макромолекула) вещество, в том числе и другой белок. Лигандами являются субстраты ферментов, кофакторы, ингибиторы и активаторы ферментов, протомеры в олигомерном белке и т.д.!}
Ppt%5C34928-slozhnye_belki_ch1_3.jpg" alt=">يتم ضمان خصوصية عالية للتفاعل بين البروتين والربيطة من خلال تكامل بنية المركز النشط مع بنية الليجند.">!}
Ppt%5C34928-slozhnye_belki_ch1_4.jpg" alt=">التكامل هو المراسلات المكانية والكيميائية للأسطح المتفاعلة. لا يجب أن يقتصر المركز النشط فقط على"> Комплементарность - это пространственное и химическое соответствие взаимодействующих поверхностей. Активный центр должен не только пространственно соответствовать входящему в него лиганду, но и между !} المجموعات الوظيفيةيجب على الجذور التي تدخل المركز النشط والربيطة أن تشكل روابط، في أغلب الأحيان غير تساهمية (تفاعلات أيونية، هيدروجينية، وكذلك تفاعلات كارهة للماء)، والتي تحمل الربيطة في المركز النشط.
Ppt%5C34928-slozhnye_belki_ch1_5.jpg" alt=">التفاعل التكميلي للبروتين مع الربيطة">!}
Ppt%5C34928-slozhnye_belki_ch1_6.jpg" alt=">">
Ppt%5C34928-slozhnye_belki_ch1_7.jpg" alt=">">
Ppt%5C34928-slozhnye_belki_ch1_8.jpg" alt="> تصنيف البروتينات 1. تتكون البروتينات البسيطة من الأحماض الأمينية فقط. 2. البروتينات المعقدة (البروتينات المجسمة)"> КЛАССИФИКАЦИЯ БЕЛКОВ 1. Простые белки состоят только из аминокислот. 2. Сложные белки (холопротеины) содержат белковую часть (апопротеин) и небелковую (простетическую) группу.!}
Ppt%5C34928-slozhnye_belki_ch1_9.jpg" alt=">يمكن أن تعمل المواد العضوية المختلفة (الدهون والكربوهيدرات) وغير العضوية (المعادن) كمجموعة صناعية."> В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества. Связь между простетической группой и апопротеином может быть как ковалентная, так и нековалентная. Простетическую группу порой можно рассматривать в качестве лиганда. Наличие небелковой части обеспечивает выполнение белком его функции. При утрате простетической группы холопротеин теряет свою активность.!}
Ppt%5C34928-slozhnye_belki_ch1_10.jpg" alt=">البروتينات المعقدة - البروتينات الملونة - البروتينات النووية - البروتينات الدهنية - البروتينات الفسفورية - البروتينات السكرية - البروتينات المعدنية">!}
Ppt%5C34928-slozhnye_belki_ch1_11.jpg" alt=">تتضمن البروتينات المعدنية إنزيمات متجانسة تحتوي على أيونات معدنية غير هيم منسقة. ومن بين البروتينات المعدنية هناك بروتينات"> Металлопротеинам можно отнести холоферменты, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеинов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов). Но и хромопротеины, содержащие ионы металлов, также можно отнести к металлопротеинам.!}
Ppt%5C34928-slozhnye_belki_ch1_12.jpg" alt=">البروتينات المعدنية غالبًا ما تكون إنزيمات. الأيونات المعدنية في هذه الحالة: - تشارك في توجيه الركيزة"> Металлопротеины часто являются ферментами. Ионы металлов в этом случае: - участвуют в ориентации субстрата в активном центре фермента, входят в состав активного центра фермента и участвуют в катализе, являясь, например, акцепторами электронов на определенной стадии ферментативной реакции. Часто ион металла в составе фермента называют кофактором.!}
Ppt%5C34928-slozhnye_belki_ch1_13.jpg" alt=">تتضمن البروتينات المعدنية الأنزيمية بروتينات تحتوي، على سبيل المثال: - النحاس - أوكسيديز السيتوكروم، في المجمع"> К ферментативным металлопротеинам относятся белки, содержащие например: - медь – цитохромоксидаза, в комплексе с другими ферментами дыхательной цепи митохондрий участвует в синтезе АТФ, - железо – ферритин, депонирующий железо в клетке, трансферрин, переносящий железо в крови, каталаза, обезвреживающая перекись водорода, - цинк – алкогольдегидрогеназа, обеспечивающая метаболизм этанола и других спиртов, лактатдегидрогеназа, участвующая в метаболизме молочной кислоты, - карбоангидраза, образующая угольную кислоту из CO2 и H2O, - щелочная фосфатаза, гидролизующая фосфорные эфиры различных соединений, - α2-макроглобулин, антипротеазный белок крови. - селен – тиреопероксидаза, участвующая в синтезе гормонов !} الغدة الدرقية، إنزيم الجلوتاثيون بيروكسيديز المضاد للأكسدة، - الكالسيوم - ألفا أميليز اللعاب وعصير البنكرياس، النشا المتحلل.
Ppt%5C34928-slozhnye_belki_ch1_14.jpg" alt=">الفيريتين">!}
Ppt%5C34928-slozhnye_belki_ch1_15.jpg" alt=">البروتينات الفسفورية هي بروتينات تحتوي على مجموعة فوسفات. وهي ترتبط بسلسلة الببتيد"> Фосфопротеины – это белки, в которых присутствует фосфатная группа. Она связывается с пептидной цепью через остатки тирозина, серина и треонина, т.е. тех аминокислот, которые содержат ОН-группу. Способ присоединения фосфата к белку на примере серина и тирозина!}
Ppt%5C34928-slozhnye_belki_ch1_16.jpg" alt=">يمكن أن يؤدي حمض الفوسفوريك: - دورًا هيكليًا، حيث ينقل الشحنة والذوبان وتغيير الخصائص"> Фосфорная кислота может выполнять: - Структурную роль, придавая заряд, растворимость и изменяя свойства белка, например, в казеине молока, яичном альбумине. Наличие остатков фосфорной кислоты способствует связыванию кальция, что необходимо для формирования, например, !} أنسجة العظام. - الدور الوظيفي. يوجد في الخلية العديد من البروتينات التي ترتبط بالفوسفات ليس بشكل دائم، ولكن اعتمادًا على النشاط الأيضي. يمكن تحويل البروتين بشكل متكرر إلى شكل مفسفر أو منزوع الفسفرة، والذي يلعب دورًا تنظيميًا في وظيفته.
Ppt%5C34928-slozhnye_belki_ch1_17.jpg" alt=">الفسفرة هي عملية نقل بقايا حمض الفوسفوريك من العامل المانح المفسفرة إلى الركيزة، عادةً"> Фосфорилирование - процесс переноса остатка фосфорной кислоты от фосфорилирующего агента-донора к субстрату, как правило, катализируемый ферментами (киназами) и ведущий к образованию эфиров фосфорной кислоты. Дефосфорилирование (утрату остатка фосфорной кислоты) катализируют фосфатазы. АТФ + R-OH → АДФ + R-OPO3H2 R-OPO3H2 + Н2О → R-OH + Н3РО4!}
Ppt%5C34928-slozhnye_belki_ch1_18.jpg" alt=">أمثلة: 1) إنزيمات سينسيز الجليكوجين وفسفوريلاز الجليكوجين 2) ترتبط الهستونات في الحالة الفسفورية بشكل أقل إحكامًا"> Примеры: 1) ферменты гликогенсинтаза и гликогенфосфорилаза 2) гистоны в фосфорилированном состоянии менее прочно связываются с ДНК и активность генома возрастает. Изменение конформации белка в фосфорилированном и дефосфорилированном состоянии!}
Ppt%5C34928-slozhnye_belki_ch1_19.jpg" alt=">تحتوي البروتينات الدهنية على دهون غير مرتبطة تساهميًا كجزء اصطناعي. الدهون، على وجه الخصوص،"> Липопротеины содержат в качестве простетической части нековалентно связанные липиды. Липиды, в частности жиры, холестерол и его эфиры не растворяются в водных фазах организма, поэтому транспорт их кровью и лимфой осуществляется в виде комплексов с белками и фосфолипидами, которые называются липопротеинами.!}
Ppt%5C34928-slozhnye_belki_ch1_20.jpg" alt=">جميع البروتينات الدهنية لها بنية مماثلة: يتكون القلب من جزيئات كارهة للماء: ثلاثي الجلسرين، واسترات الكوليسترول، و"> Все липопротеины имеют сходное строение: ядро состоит из гидрофобных молекул: триацилглицеролов, эфиров холестерола, а на поверхности находится монослой фосфолипидов, полярные группы которых обращены к воде, а гидрофобные погружены в гидрофобное ядро липопротеина. Кроме фосфолипидов, на поверхности находятся белки – аполипопротеины (апобелками). Их выделяют несколько видов: А, В, С, D. В каждом типе липопротеинов преобладают соответствующие ему апобелки. Аполипопротеины выполняют различные функции. Интегральные аполипопротеины являются структурными компонентами. Периферические аполипопротеины в плазме крови могут передаваться от одного типа липопротеинов к другим, определяя их дальнейшие превращения.!}
Ppt%5C34928-slozhnye_belki_ch1_21.jpg" alt=">مخطط بنية البروتين الدهني هيكل البروتين الدهني">!}
Ppt%5C34928-slozhnye_belki_ch1_22.jpg" alt=">بنية البروتينات الدهنية في بلازما الدم">!}
Ppt%5C34928-slozhnye_belki_ch1_23.jpg" alt=">هناك أربع فئات رئيسية من البروتينات الدهنية: - البروتينات الدهنية عالية الكثافة (HDL)، - البروتينات الدهنية منخفضة الكثافة (LDL)،"> Выделяют четыре основных класса липопротеинов: -липопротеины высокой плотности (ЛПВП), -липопротеины низкой плотности (ЛПНП), -липопротеины очень низкой плотности (ЛПОНП), -хиломикроны (ХМ). Каждый из типов ЛП образуется в разных тканях и транспортирует определённые липиды. Концентрация и соотношение в крови тех или иных липопротеинов играют ведущую роль в возникновении такой распространенной !} أمراض الأوعية الدمويةمثل تصلب الشرايين. HDL هي مضادات تصلب الشرايين، LDL وVLDL هي تصلب الشرايين.
Ppt%5C34928-slozhnye_belki_ch1_24.jpg" alt=">">
Ppt%5C34928-slozhnye_belki_ch1_25.jpg" alt=">البروتينات السكرية أو المترافقات السكرية هي بروتينات تحتوي على مكون كربوهيدرات مرتبط تساهميًا بالعمود الفقري متعدد الببتيد."> Гликопротеины или, гликоконъюгаты – это белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов в них варьирует от 1% до 98% по массе. Два подкласса белков, содержащих углеводы: ■ протеогликаны ■ гликопротеины!}
الوصف = "">
Ppt%5C34928-slozhnye_belki_ch1_27.jpg" alt=">تتميز البروتينات السكرية بمحتوى منخفض من الكربوهيدرات، والتي ترتبط: - بواسطة رابطة N-glycosidic مع مجموعة NH2 من بعض"> Для гликопротеинов характерно невысокое содержание углеводов, которые присоединены: - N-гликозидной связью к NН2-группе какого-нибудь аминокислотного остатка, например, аспарагина; - О-гликозидной связью к гидроксильной группе остатка серина, треонина,тирозина, гидроксилизина.!}
Ppt%5C34928-slozhnye_belki_ch1_28.jpg" alt=">تكوين روابط O- وN-glycosidic في البروتينات السكرية. 1 - رابطة N-glycosidic بين مجموعة الأميد"> Образование О- и N-гликозидных связей в гликопротеинах. 1 - N-гликозидная связь между амидной группой аспарагина и ОН-группой моносахарида; 2 - О-гликозидная связь между ОН-группой серина и ОН-группой моносахарида.!}
Ppt%5C34928-slozhnye_belki_ch1_29.jpg" alt=">طريقة إضافة الكربوهيدرات إلى البروتين">!}
Ppt%5C34928-slozhnye_belki_ch1_30.jpg" alt=">وظائف البروتينات السكرية هي: 1. الهيكلية - جدار الخلية البكتيرية، ومصفوفة العظام، على سبيل المثال، الكولاجين والإيلاستين."> Функцией гликопротеинов являются: 1. Структурная – клеточная стенка бактерий, костный матрикс, например, коллаген, эластин. 2. Защитная – например, антитела, интерферон, факторы свертывания крови (протромбин, фибриноген). 3. Рецепторная – присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ. 4. Гормональная – гонадотропный, адренокортикотропный и тиреотропный гормоны. 5. Ферментативная – холинэстераза, нуклеаза. 6. Транспортная – перенос веществ в крови и через мембраны, например, трансферрин, транскортин, альбумин, Na+,К+-АТФаза.!}
Ppt%5C34928-slozhnye_belki_ch1_31.jpg" alt=">مخطط هيكلي لبروتين المستقبل">!}
Ppt%5C34928-slozhnye_belki_ch1_32.jpg" alt=">Chromoproteins - الاسم الجماعي البروتينات المعقدةمع مجموعات صناعية ملونة مختلفة الطبيعة الكيميائية. "> البروتينات الكرومية هي الاسم الجماعي للبروتينات المعقدة ذات المجموعات الاصطناعية الملونة ذات الطبيعة الكيميائية المختلفة. بروتينات الدم (تحتوي على الهيم)، بروتينات الشبكية (تحتوي على فيتامين أ)، بروتينات الفلافوبروتينات (تحتوي على فيتامين ب2)، بروتينات الكوباميد (تحتوي على فيتامين ب12).
Ppt%5C34928-slozhnye_belki_ch1_33.jpg" alt=">بروتينات الفلافو هي إنزيمات تفاعلات الأكسدة والاختزال. وتحتوي على مشتقات فيتامين ب2 أحادي نيوكليوتيد الفلافين (FMN) وفلافين أدينين ثنائي النوكليوتيد."> Флавопротеины - это ферменты окислительно-восстановительных реакций. Содержат производные витамина В2 флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Связываются данные простетические группы ковалентно и придают !} التلوين الأصفر. هذه المجموعات الاصطناعية هي من مشتقات الإيزوألوكسازين.
Ppt%5C34928-slozhnye_belki_ch1_34.jpg" alt=">إيسوالوكسازين - مركبات حلقية غير متجانسة، مشتق البتريدين. يتكون جزيء الإيزوآلوكسازين من ثلاث حلقات عطرية - "> الإيزوآلوكسازين مركب حلقي غير متجانس، مشتق من البتيريدين. يتكون جزيء الإيزوآلوكسازين من ثلاث حلقات عطرية - البنزين، بيريميدين، بيرازين.
Ppt%5C34928-slozhnye_belki_ch1_35.jpg" alt=">بروتينات الدم هي بروتينات ملونة تحتوي على الهيم. وهي تشتمل على بورفيرينات حديد أو مغنيسيوم مشابهة من الناحية الهيكلية كمكون غير بروتيني."> Гемопротеины - гем-содержащие хромопротеины. В качестве небелкового компонента включают структурно сходные железо- или магнийпорфирины. Белковый компонент может быть разнообразным как по составу, так и по структуре. Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Порфирин!}
Ppt%5C34928-slozhnye_belki_ch1_36.jpg" alt=">حلقة البورفيرين قادرة على تكوين مركبات تنسيق مع أيونات معدنية مختلفة. نتيجة للتعقيد،"> Порфириновое кольцо способно образовывать координационные соединения с различными ионами металлов. В результате комплексообразования формируются металлопорфирины: содержащие ионы железа – гемоглобины, миоглобин, цитохромы, пероксидаза, каталаза и др. (красное окрашивание), содержщие ионы магния – хлорофилл (зеленое окрашивание). Витамин В12 (кобалимин) содержит координированный ион кобальта Со2+ в порфириноподобном макроцикле – коррине, состоящем из четырех частично гидрированных пиррольных колец (розовое окрашивание).!}
Ppt%5C34928-slozhnye_belki_ch1_37.jpg" alt=">الكلوروفيل ب. يشارك الكلوروفيل في عمليات التمثيل الضوئي.">!}
Ppt%5C34928-slozhnye_belki_ch1_38.jpg" alt=">تختلف السيتوكرومات في تركيب الأحماض الأمينية للسلاسل الببتيدية وعدد السلاسل وتنقسم إلى أنواع أ، ب،"> Цитохромы различаются аминокислотным составом пептидных цепей, числом цепей и разделяются на типы а, b, с, d. Цитохромы находятся в составе дыхательной цепи и цепи микросомального окисления. Степень окисления железа в составе цитохромов меняется в отличие от гемоглобина и миоглобина Fe2+ ↔ Fe3+!}
Ppt%5C34928-slozhnye_belki_ch1_39.jpg" alt=">الميوجلوبين (MB) هو بروتين موجود في العضلات الحمراء، وتتمثل وظيفته الرئيسية في تكوين احتياطيات."> Миоглобин (Мв) - белок, находящийся в красных мышцах, основная функция которого - создание запасов О2, необходимых при интенсивной мышечной работе. Мв - сложный белок, содержащий белковую часть - апоМв и небелковую часть - гем. Первичная структура апоМв определяет его компактную глобулярную конформацию и структуру активного центра, к которому присоединяется небелковая часть миоглобина - гем. Кислород, поступающий из крови в мышцы, связывается с Fe2+ гема в составе миоглобина. Мв - мономерный белок, имеющий очень высокое сродство к О2, поэтому отдача кислорода миоглобином происходит только при интенсивной мышечной работе, когда парциальное давление O2 резко снижается. Формирование пространственных структур и функционирование миоглобина.!}
Ppt%5C34928-slozhnye_belki_ch1_40.jpg" alt=">تكوين الشكل MV. في العضلات الحمراء، يحدث تخليق البروتين الأساسي على الريبوسومات أثناء الترجمة"> Формирование конформации Мв. В красных мышцах на рибосомах в ходе трансляции идет синтез первичной структуры Мв, представленной специфической последовательностью 153 аминокислотных остатков. Вторичная структура Мв содержит восемь α-спиралей, называемых латинскими буквами от А до Н, между которыми имеются неспирализованные участки. Третичная структура Мв имеет вид компактной глобулы, в углублении которой между F и Е α-спиралями расположен активный центр.!}
Ppt%5C34928-slozhnye_belki_ch1_41.jpg" alt=">بنية الميوجلوبين">!}
Ppt%5C34928-slozhnye_belki_ch1_42.jpg" alt=">ملامح هيكل وعمل المركز النشط لـ Mv. يتكون المركز النشط لـ Mv في الغالب من جذور كارهة للماء"> Особенности строения и функционирования активного центра Мв. Активный центр Мв сформирован преимущественно гидрофобными радикалами аминокислот, далеко отстоящими друг от друга в первичной структуре (например, Три39 и Фен138). К активному центру присоединяется плохо растворимые в воде лиганды - гем и О2. Гем - специфический лиганд апоМв.!}
Ppt%5C34928-slozhnye_belki_ch1_43.jpg" alt=">يتكون أساس الهيم من أربع حلقات بيرول متصلة بواسطة جسور الميثيل؛ وفي المركز توجد ذرة Fe2+،"> Основу гема составляют четыре пиррольных кольца, соединенных метенильными мостиками; в центре расположен атом Fe2+, соединенный с атомами азота пиррольных колец четырьмя координационными связями. В активном центре Мв кроме гидрофобных радикалов аминокислот имеются также остатки двух аминокислот с гидрофильными радикалами - Гис Е7 (Гис64) и Гис F8 (Гис93).!}
Ppt%5C34928-slozhnye_belki_ch1_44.jpg" alt=">يشكل F8 الخاص به رابطة تنسيق مع Fe2+ ويثبت الهيم بقوة في الموقع النشط."> Гис F8 образует координационную связь с Fe2+ и прочно фиксирует гем в активном центре. Гис Е7 необходим для правильной ориентации в активном центре другого лиганда - O2 при его взаимодействии с Fe+2 гема. Микроокружение гема создает условия для прочного, но обратимого связывания O2 с Fe+2 и препятствует попаданию в гидрофобный активный центр воды, что может привести к его окислению в Fе3+.!}
Ppt%5C34928-slozhnye_belki_ch1_45.jpg" alt=">البنية قليلة القسيمات لـ HB وتنظيم تقارب HB لـ O2 بواسطة الروابط. الهيموجلوبين البشري -"> Олигомерное строение Нв и регуляция сродства Нв к О2 лигандами. Гемоглобины человека - семейство белков, так же как и миоглобин относящиеся к сложным белкам (гемопротеинам). Они имеют тетрамерное строение и содержат две α-цепи, но различаются по строению двух других полипептидных цепей (2α-, 2х-цепи). Строение второй полипептидной цепи определяет особенности функционирования этих форм Нв. Около 98% гемоглобина эритроцитов взрослого человека составляет гемоглобин А (2α-, 2β-цепи). В период !} التطور داخل الرحمهناك نوعان رئيسيان من الهيموجلوبين: الهيموجلوبين الجنيني (2α، 2ε)، والذي يوجد في المراحل المبكرة من نمو الجنين، والهيموجلوبين F (الجنيني) - (2α، 2γ)، والذي يحل محل الهيموجلوبين الجنيني المبكر في الشهر السادس من يتم استبدال التطور داخل الرحم وفقط بعد الولادة بـ Hv A.
Ppt%5C34928-slozhnye_belki_ch1_46.jpg" alt=">Hb A هو بروتين مرتبط بالميوجلوبين (Mb)، ويوجد في خلايا الدم الحمراء للشخص البالغ. بنيته"> Нв А - белок, родственный миоглобину (Мв), содержится в эритроцитах взрослого человека. Строение его отдельных протомеров аналогично таковому у миоглобина. Вторичная и третичная структуры миоглобина и протомеров гемоглобина очень сходны, несмотря на то что в первичной структуре их полипептидных цепей идентичны только 24 аминокислотных остатка (вторичная структура протомеров гемоглобина, так же как миоглобин, содержит восемь α-спиралей, обозначаемых латинскими буквами от А до Н, а третичная структура имеет вид компактной глобулы). Но в отличие от миоглобина гемоглобин имеет олигомерное строение, состоит из четырех полипептидных цепей, соединенных нековалентными связями.!}
Ppt%5C34928-slozhnye_belki_ch1_47.jpg" alt=">التركيب قليل القسيمات للهيموجلوبين">!}
Ppt%5C34928-slozhnye_belki_ch1_48.jpg" alt=">يرتبط كل بروتومر Hb بجزء غير بروتيني - الهيم والبروتومرات المجاورة. اتصال البروتين"> Каждый протомер Нв связан с небелковой частью - гемом и соседними протомерами. Соединение белковой части Нв с гемом аналогично таковому у миоглобина: в активном центре белка гидрофобные части гема окружены гидрофобными радикалами аминокислот за исключением Гис F8 и Гис Е7, которые расположены по обе стороны от плоскости гема и играют аналогичную роль в функционировании белка и связывании его с кислородом. Кроме того, Гис Е7 выполняет важную дополнительную роль в функционировании Нв. Свободный гем имеет в 25 000 раз более высокое сродство к СО, чем к О2. СО в небольших количествах образуется в организме и, учитывая его высокое сродство к гему, он мог бы нарушать транспорт необходимого для жизни клеток О2. Однако в составе гемоглобина сродство гема к оксиду углерода превышает сродство к О2 всего в 200 раз благодаря наличию в активном центре Гис Е7. Остаток этой аминокислоты создает оптимальные условия для связывания гема с O2 и ослабляет взаимодействие гема с СО.!}
Ppt%5C34928-slozhnye_belki_ch1_49.jpg" alt=">">
Ppt%5C34928-slozhnye_belki_ch1_50.jpg" alt=">توجد حلقات البيرول للهيم في نفس المستوى، ويكون أيون Fe2+ في الحالة غير المؤكسجة Hb"> Пиррольные кольца гема расположены в одной плоскости, а ион Fe2+ в неоксигенированом состоянии Hb выступает над плоскостью на 0,6 А. При присоединении кислорода ион железа погружается в плоскость колец гема. В результате сдвигается и участок полипептидной цепи, нарушаются слабые связи в молекуле Hb и изменяется конформация всей глобулы. Таким образом, присоединение кислорода вызывает изменение пространственной структуры молекулы миоглобина или протомеров гемоглобина.!}
Ppt%5C34928-slozhnye_belki_ch1_51.jpg" alt=">يمكن أن يتواجد الهيموجلوبين في صورة حرة (ديوكسي هيموجلوبين) وفي صورة مؤكسجة، مما يصل إلى"> Гемоглобин может существовать как в свободной (дезоксигемоглобин), так и в оксигенированной форме, присоединяя до 4 молекул кислорода. Взаимодействие с кислородом 1-го протомера вызывает изменение его конформации, а также кооперативные конформационные изменения остальных протомеров. Сродство к кислороду возрастает, и присоединение О2 к активному центру 2-го протомера происходит легче, вызывая дальнейшую конформационную перестройку всей молекулы. В результате еще сильнее изменяется структура оставшихся протомеров и их активных центров, взаимодействие с О2 еще больше облегчается. В итоге 4-я молекула кислорода присоединяется к Hb примерно в 300 раз легче, чем 1-я. Так происходит в легких при высоком парциальном давлении кислорода.!}
Ppt%5C34928-slozhnye_belki_ch1_52.jpg" alt=">التغيرات التعاونية في شكل جزيء الهيموجلوبين عند التفاعل مع الأكسجين">!}
Ppt%5C34928-slozhnye_belki_ch1_53.jpg" alt=">في الأنسجة التي يكون فيها محتوى الأكسجين أقل، على العكس من ذلك، يسهل انقسام كل جزيء O2 إطلاق الجزيئات اللاحقة."> В тканях, где содержание кислорода ниже, наоборот, отщепление каждой молекулы О2 облегчает освобождение последующих. Таким образом, взаимодействие олигомерного белка гемоглобина с лигандом (О2) в одном центре связывания приводит к изменению конформации всей молекулы и других, пространственно удаленных центров, расположенных на других субъединицах (принцип «домино»). Подобные взаимосвязанные изменения структуры белка называют кооперативными конформационными изменениями. Они характерны для всех олигомерных белков и используются для регуляции их активности.!}
Ppt%5C34928-slozhnye_belki_ch1_54.jpg" alt=">يعتمد تفاعل كلا البروتينين (Mb وHb) مع الأكسجين على ضغطه الجزئي في"> Взаимодействие обоих белков (Mb и Hb) с кислородом зависит от его парциального давления в тканях. Эта зависимость имеет разный характер, что связано с их особенностями структуры и функционирования. Гемоглобин имеет S-образную кривую насыщения, которая показывает, что субъединицы белка работают кооперативно, и чем больше кислорода они отдают, тем легче идет освобождение остальных молекул О2. Этот процесс зависит от изменения парциального давления кислорода в тканях. График насыщения миоглобина кислородом имеет характер простой гиперболы, т.е. насыщение Mb кислородом происходит быстро и отражает его функцию - обратимое связывание с кислородом, высвобождаемым гемоглобином, и освобождение в случае интенсивной физической нагрузки.!}
Ppt%5C34928-slozhnye_belki_ch1_55.jpg" alt=">منحنيات تشبع الميوجلوبين والأكسجين بالهيموجلوبين">!}
Ppt%5C34928-slozhnye_belki_ch1_56.jpg" alt=">CO2 وH+ يتشكلان أثناء عملية الهدم المواد العضوية، تقليل تقارب الهيموجلوبين لـ O2 بما يتناسب مع "> CO2 و H+، المتكون أثناء تقويض المواد العضوية، تقليل تقارب الهيموجلوبين لـ O2 بما يتناسب مع تركيزها. يتم إنتاج الطاقة اللازمة لوظيفة الخلية بشكل رئيسي في الميتوكوندريا خلال أكسدة المواد العضوية باستخدام الأكسجين الذي يأتي من الهيموجلوبين في الرئتين يتشكل نتيجة أكسدة المواد العضوية. المنتجات النهائيةتقسيمها: CO2 وH2O، والتي تتناسب كميتها مع شدة عمليات الأكسدة الجارية. ينتشر ثاني أكسيد الكربون من الخلايا إلى الدم ويتغلغل في خلايا الدم الحمراء، حيث يتحول تحت تأثير إنزيم الأنهيدراز الكربونيك إلى حمض الكربونيك. وينفصل هذا الحمض الضعيف إلى بروتون وأيون بيكربونات. CO2 + H2O → H2CO3 → H+ + HCO3-
Ppt%5C34928-slozhnye_belki_ch1_57.jpg" alt=">أيونات H+ قادرة على الانضمام إلى جذور His146 في سلاسل بيتا من الهيموجلوبين، أي في المناطق النائية"> Ионы Н+ способны присоединятся к радикалам Гис146 в β-цепях гемоглобина, т.е. в участках, удаленных от гема. Протонирование гемоглобина снижает его сродство к О2, способствует отщеплению О2 от оксиНв, образованию дезоксиНв и увеличивает поступление кислорода в ткани пропорционально количеству образовавшихся протонов. Увеличение количества освобожденного кислорода в зависимости от увеличения концентрации Н+ в эритроцитах называется эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект). В легких высокое парциальное давление кислорода способствует его связыванию с дезоксиНв, что уменьшает сродство белка к Н+. Освободившиеся протоны под действием карбоангидразы взаимодействуют с бикарбонатами с образованием СО2 и Н2О!}
Ppt%5C34928-slozhnye_belki_ch1_58.jpg" alt=">اعتماد ألفة Hb لـ O2 على تركيز ثاني أكسيد الكربون والبروتونات (تأثير بور): A -"> Зависимость сродства Нв к О2 от концентрации СО2 и протонов (эффект Бора): А - влияние концентрации СО2 и Н+ на высвобождение О2 из комплекса с Нв (эффект Бора); Б - оксигенирование дезоксигемоглобина в легких, образование и выделение СО2.!}
Ppt%5C34928-slozhnye_belki_ch1_59.jpg" alt=">يدخل ثاني أكسيد الكربون الناتج إلى الحيز السنخي ويتم إزالته بهواء الزفير. وبالتالي، فإن الكمية"> Образовавшийся СО2 поступает в альвеолярное пространство и удаляется с выдыхаемым воздухом. Таким образом, количество высвобождаемого гемоглобином кислорода в тканях регулируется продуктами катаболизма органических веществ: чем интенсивнее распад веществ, например при физических нагрузках, тем выше концентрация СО2 и Н+ и тем больше кислорода получают ткани в результате уменьшения сродства Нв к О2.!}
Ppt%5C34928-slozhnye_belki_ch1_60.jpg" alt=">يسمى التغيير في النشاط الوظيفي للبروتين عند التفاعل مع الروابط الأخرى بسبب التغيرات التوافقية بالتباين"> Изменение функциональной активности белка при взаимодействии с другими лигандами вследствие конформационных изменений называется аллостерической регуляцией, а соединения-регуляторы - аллостерическими лигандами или эффекторами. Способность к аллостерической регуляции характерна, как правило, для олигомерных белков, т.е. для проявления аллостерического эффекта необходимо взаимодействие протомеров. При воздействии аллостерических лигандов белки меняют свою конформацию (в том числе и активного центра) и функцию.!}
Ppt%5C34928-slozhnye_belki_ch1_61.jpg" alt=">التنظيم التفارفي لتقارب Hb لـ O2 بواسطة المركب - 2,3-bis-phosphoglycerate. في كريات الدم الحمراء من المنتج"> Аллостерическая регуляция сродства Нв к О2 лигандом - 2,3-бис-фосфоглицератом. В эритроцитах из продукта окисления глюкозы - 1,3-бисфосфоглицерата синтезируется аллостерический лиганд гемоглобина - 2,3-бисфосфоглицерат (2,3-БФГ). В !} الظروف العاديةتركيز 2,3-BPG مرتفع ويمكن مقارنته بتركيز Hb. 2,3-BPG له شحنة سالبة قوية (-5).
Ppt%5C34928-slozhnye_belki_ch1_62.jpg" alt=">يوجد تجويف في مركز جزيء الهيموجلوبين رباعي القسيم. ويتكون من بقايا الأحماض الأمينية لجميع البروتومرات الأربعة."> В центре тетрамерной молекулы гемоглобина находится полость. Ее образуют аминокислотные остатки всех четырех протомеров. В капиллярах тканей протонирование Нв (эффект Бора) приводит к разрыву связи между железом гема и О2. В молекуле дезоксигемоглобина по сравнению с оксигемоглобином возникают дополнительные ионные связи, соединяющие протомеры, вследствие чего размеры центральной полости по сравнению с оксигемоглобином увеличиваются. Центральная полость является местом присоединения 2,3-БФГ к гемоглобину. БФГ поступает в полость дезоксигемоглобина. 2,3-БФГ взаимодействует с гемоглобином в участке, удаленном от активных центров белка и относится к аллостерическим (регуляторным) лигандам, а центральная полость Нв является аллостерическим центром. 2,3-БФГ имеет сильный отрицательный заряд и взаимодействует с положительно заряженными группами двух β-цепей Нв. При этом его сродство к О2 снижается в 26 раз. В результате происходит высвобождение кислорода в капиллярах ткани при низком парциальном давлении О2. В легких высокое парциальное давление О2, наоборот, приводит к оксигенированию Нв и освобождению БФГ.!}
Ppt%5C34928-slozhnye_belki_ch1_63.jpg" alt=">يقع موقع ربط BPG في التجويف الموجب الشحنة بين بروتومرات الهيموجلوبين الأربعة. تفاعل BPG"> Центр связывания БФГ находится в положительно заряженной полости между 4 протомерами гемоглобина. Взаимодействие БФГ с центром связывания изменяет конформацию α- и β-протомеров НЬ и их активных центров. Сродство НЬ к молекулам О2 снижается и кислород высвобождается в ткани. В легких при высоком парциальном давлении О2 активные центры гемоглобина насыщаются за счет изменения конформации и БФГ вытесняется из аллостерического центра!}
Ppt%5C34928-slozhnye_belki_ch1_64.jpg" alt=">">
Ppt%5C34928-slozhnye_belki_ch1_65.jpg" alt=">وبالتالي، فإن البروتينات قليلة القسيم لها خصائص جديدة مقارنة بالبروتينات الأحادية."> Таким образом, олигомерные белки обладают новыми по сравнению с мономерными белками свойствами. Присоединение лигандов на участках, пространственно удаленных друг от друга (аллостерических), способно вызывать конформационные изменения во всей белковой молекуле. Благодаря взаимодействию с регуляторными лигандами происходит изменение конформации и адаптация функции белковой молекулы к изменениям окружающей среды.!}
Ppt%5C34928-slozhnye_belki_ch1_66.jpg" alt=">حوالي 15% من ثاني أكسيد الكربون الموجود في الدم تحمله جزيئات الهيموجلوبين. وفي الأنسجة، بعض الجزيئات"> Около 15% углекислого газа, присутствующего в крови, переносится молекулами гемоглобина. В тканях часть молекул углекислого газа может присоединится к каждому протомеру молекулы гемоглобина, при этом снижается сродство Hb к кислороду. В легких, наоборот, из-за высокого парциального давления кислорода, О2 связывается с Hb, а СО2 высвобождается.!}
Ppt%5C34928-slozhnye_belki_ch1_67.jpg" alt=">">
Ppt%5C34928-slozhnye_belki_ch1_68.jpg" alt=">في جزيء الهيموجلوبين S (ما يسمى بالهيموجلوبين غير الطبيعي)، تبين أن سلسلتين بيتا متحولتان، حيث"> В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались 2 β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.!}