ГЛАВА 2 АСЕПТИКА И АНТИСЕПТИКА
ГЛАВА 2 АСЕПТИКА И АНТИСЕПТИКА
Общие положения, определения
Асептика (а - без, septicus - гниение) - безгнилостный метод работы.
Асептика - совокупность методов и приёмов работы, направлен- ных на предупреждение попадания инфекции в рану, в организм больного, создание безмикробных, стерильных условий для хирургической работы путём использования организационных мероприятий, активных обеззараживающих химических веществ, а также технических средств и физических факторов.
Он хотел лишить людей чувства страха, сопровождающего каждое посещение врача. Он также мечтал о вакцинации людей от инфекционных заболеваний. В те дни пациенты были ужалены в больницах между двумя поддонами, чтобы уменьшить их страдания. Тем не менее, гонщики хотели рисковать своей жизнью, чтобы помочь добросердечному доктору, который никогда не возвышал их и не относился к ним одинаково. Сэм Пастер также рискнул всасывания, используя стеклянную трубку, чтобы получить необходимое яичко больной собаки.
Однако в собранных образцах он не обнаружил микроорганизмов. Были и в зараженном мозге. Единственным исключением было так называемое. Живая собака или собака-сон с микроскопической вставкой спинного мозга мертвого животного с помощью шприца. Ранку был разведен, и через 14 дней собака умерла, что стало последним доказательством расположения искомых микробов. Эта работа была сделана тайно доцентом, потому что чувствительный Пастер любил животное и не терпел боли. Как только он это сделал, он использовал наркотик, и после экспериментов он прошел между клетками и извинился перед своими обвинениями в страданиях.
Следует особо подчеркнуть значение организационных мероприятий: именно они становятся определяющими. В современной асептике сохранили своё значение два основных её принципа:
Всё, что соприкасается с раной, должно быть стерильно;
Всех хирургических больных необходимо разделять на два потока: «чистые» и «гнойные».
Антисептика (anti - против, septicus - гниение) - противогнилостный метод работы. Термин «антисептика» в 1750 г. ввёл английский хирург Дж. Прингл, описавший антисептическое действие хинина.
Все собаки в мире должны быть вакцинированы. Но их было слишком много, и впечатывание людей было еще слишком рискованным, потому что они угрожали непредвиденными осложнениями. Пациент был девятилетним Юзефом Майстером, которого укусил собака по дороге в школу. Отчаянные родители попросили Пастера помочь. Мальчику вводили серию инъекций, и во время этой терапии расстроили и приняли Пастера в возрасте 10 лет. Но он чувствовал себя очень хорошо и любил старого профессора, от которого он получил морскую ошибку, и многих других животных, которые ученый обещал спасти от жестоких исследований.
Антисептика - система мероприятий, направленных на уничтожение микроорганизмов в ране, патологическом очаге, органах и тканях, а также в организме больного в целом, использующая механические и физические методы воздействия, активные химические вещества и биологические факторы.
Таким образом, если асептика предупреждает попадание микроорганизмов в рану, то антисептика уничтожает их в ране и организме пациента.
Слова остались, и мальчик и его подруга долгое время наслаждались очень хорошим здоровьем. Несмотря на успех, Пастер не волновался. Его следующим пациентом был пятнадцатилетний Юпиль, сильно укушенный собакой. Когда зверь напал на детей, храбрый мальчик вышел, чтобы помочь им. Он получил много травм. Его юбилейный акт был до поступления в Институт Пастера, где пациент был завербован на работу в качестве портера.
Слава Пастера была смешана с презрением. Его метод был ненадежным, и каждое преследование было предано гласности в прессе. Однако в большинстве случаев вакцина была эффективной и спасла много жизней, что обеспечило достаточную мотивацию для работы. Крики вечных противников не смогли преодолеть упрямство микроба. Нищета и терпение остались неизменными. Несмотря на работу, он всегда находил время для ремонта сломанной игрушки своих маленьких пациентов, и с карманами, как свечи, он нес конфеты, скрытые для них.
Работать без соблюдения правил асептики и антисептики в хирургии невозможно. Внедрение во внутреннюю среду организма больного - основное отличие хирургических методов. Если при этом у больного возникнет осложнение инфекционного характера в связи с тем, что извне в организм попали микробы, то в настоящее время его будут считать ятрогенным осложнением, так как его развитие связано с недостатками деятельности хирургической службы.
Однако на этот раз он не отказался от своих исследований. А анекдот говорит вам, что когда его попросили почивать на лаврах, он так усердно трудился, что ответил: «Я кролик в креме?». Но профессор был достаточно слаб, чтобы сказать, что он открыто говорил через своего сына. Это был день, когда на носилках была сделана юбка-лаборатория. Это был королевский праздник, на котором он получил письменные поздравления от отдельных университетов и научных обществ. Было много выдающихся гостей, почетный салют, марсель и галантно одетых солдат.
Однако его ум и дух оставались сильными, как в юношеские годы. Ру в Лилль за цикл лекций по библии. После четырех часов бессознательного он проснулся и попросил, чтобы первый раз не остался один. В течение 55 дней его друзья и семья смотрели на него. В прошлом месяце он жил в Вильнёв-лэтанг в простой комнате лаборатории.
Асептика
Чтобы предупредить попадание инфекции в рану, прежде всего нужно знать её источники и пути распространения (рис. 2-1).
Инфекцию, попадающую в рану из внешней среды, называют экзогенной. Основные её источники: воздух с частицами пыли, на которых оседают микроорганизмы; выделения из носоглотки и верхних дыха- тельных путей больных, посетителей и медперсонала; раневое отделяемое из гнойных ран, различные бытовые загрязнения.
Позднее были похоронные торжества. Известный ученый был найден в соборе в Париже с королевскими почестями. Тысячи людей жили в монастыре. Тысячи людей поклонились перед тем, как нести гроб, содержащий тело человека, который спас тысячи человеческих жизней, и относился к каждому из них исключительно.
Убийца невидимых хищников. Издательский дом «Катовице», Катовице. Стоматологический кабинет - это место, где пациент доверяет нам свое здоровье. Она хочет чувствовать себя в безопасности и уверенно. Обычно первое впечатление самое главное. Это элегантно - хорошо, но это еще не все. И нечего скрывать, первый взгляд на офис часто решает, вернется ли пациент.
Рис. 2-1. Основные пути распространения инфекции
В рану больному экзогенная инфекция может проникнуть тремя основными путями: воздушно-капельным, контактным и импланта- ционным.
Инфекцию, попадающую в рану из организма самого больного, называют эндогенной. Основные её источники: кожа пациента, внутренние органы, патологические очаги.
Но то, что не видно, намного здоровее. Кабинет из-за большого вращения людей и видов обработанных процедур может быть источником патогенных микроорганизмов. Пациенты подвергаются инфекции, но также и работники. Поэтому необходимо следовать процедуре антисептика и асептики стоматологического кабинета.
Микроорганизмы в офисе могут передаваться капельками, контактами и имплантатами. Инфекция вызвана разрывом кожи с острыми инструментами, которые контактируют с кровью и биологическими жидкостями. Они также могут быть достигнуты во время работы гигиениста или помощника стоматолога во время операции, но также и при чистке инструментов.
Профилактика воздушно-капельной инфекции
При воздушно-капельном пути распространения инфекции микроорганизмы попадают в рану из окружающего воздуха, где они на- ходятся на частицах пыли или в каплях выделений из верхних дыхательных путей либо раневого отделяемого.
Для профилактики воздушно-капельной инфекции применяют комплекс мер, главные из них - организационные мероприятия, свя- занные с особенностью работы хирургических отделений и стационара в целом.
Поэтому важно проводить мероприятия, направленные на уничтожение микробов и препятствование их развитию. И особенно важно предотвратить инфекцию. Элементарные асептические принципы в офисе включают, в частности, дезинфекцию и стерилизацию и надлежащее хранение стерильных инструментов и материалов. Используйте каждый пациент, очищенный и очищенный. Абсолютное использование одноразового оборудования, перчаток и защитных масок.
Еще одна важная проблема - личная гигиена. Итак, мытье правой руки. Обратите внимание, что использование защитных перчаток не освобождает руки и не использует антисептики. Что должно быть легко диагностировать, что кто-то работает в офисе стоматолога? Только после ухода за руками. Нет росистой кожи, увлажненной кожи и коротких ногтей.
Особенности организации и устройства хирургического стационара
Принцип соблюдения правил асептики и антисептики лежит в основе организации хирургического стационара. Это необходимо для профилактики раневой инфекции, создания максимума условий для выполнения операций, обследования и послеоперационного ухода за больными.
Вам необходимо следовать нескольким правилам, чтобы защитить своего пациента и себя от коинфекции. К числу очевидных исключений относятся рекомендации по вакцинации против гепатита и гриппа. К сожалению, по соображениям безопасности любой материал пациента должен рассматриваться как потенциальный источник патогенных микроорганизмов, которые представляют угрозу для персонала и пациентов.
Стоит иметь в виду, что, если мы делаем много вещей каждый день, иногда рутина и соблазн проскользнуть. Давайте посмотрим правде в глаза, рутина для нашей безопасности. аб. В последние годы все больше и больше родителей боятся обязательной иммунизации своих детей. В средствах массовой информации мы найдем много свидетельств родителей, комфорт которых в результате пост-реакции был серьезно ухудшен. Эти нежелательные побочные эффекты, по мнению многих педиатров, ставят вопрос о том, являются ли обязательные прививки законными, а некоторые независимые профессора-медики критикуют использование вакцин, особенно для младенцев и детей младшего возраста.
Основные структурные подразделения хирургического стационара включают приёмное отделение, лечебно-диагностические отделения и операционный блок.
Приёмное отделение
Приёмное отделение (приёмный покой) предназначено для при- ёма пациентов, направленных из амбулаторных лечебных учреждений (поликлиники, здравпункта и пр.), доставленных машинами скорой или неотложной помощи, или обращающихся за помощью самостоятельно.
Что нужно знать о вакцинации?
Идея принудительной вакцинации, особенно младенцев, несомненно, является серьезной и неотложной медицинской проблемой, которую наши лица, принимающие решения, должны проявлять осторожность и осторожность, не пренебрегая многочисленными, стойкими нарушениями, особенно нервной системой, вакцинированных детей. Даже если бы это были спорадические случаи, это привело бы к очень сложной личной и социальной ситуации, чаще всего к молодым супругам и родителям, чьи дети становятся иммунизированными после вакцинации.
Устройство приёмного отделения
Приёмное отделение должно иметь следующие помещения: вестибюль, регистратура, справочное бюро, смотровые кабинеты. В крупных многопрофильных больницах, кроме этого, должны быть
лаборатория, изоляторы, диагностические кабинеты, палаты, где больных лечат и обследуют в течение нескольких часов для уточнения диагноза, а также операционные, перевязочные и реанимационный зал (противошоковая палата). Организация работы
Такие факты нельзя игнорировать, тем более, что вакцинация может вызывать не только серьезные осложнения, но даже смерть ребенка. Размышляя над легитимностью вакцинации, стоит задать некоторые основные вопросы. Существуют ли рациональные научные аргументы, которые доказывают необходимость вакцинации новорожденных и младенцев или оправдывают эти прививки? Напротив: разумный, рациональный подход к проблеме профилактической вакцинации не должен исключать использование вакцин у детей? Следует ли избегать ограничений инфекционных заболеваний общим обязательством соблюдать правила гигиены, очень важный принцип изоляции больных людей, улучшения условий жизни, всеобщего доступа к чистой воде, эффективного сброса и дезактивации загрязняющих веществ?
В приёмном отделении проводят регистрацию больных, врачебный осмотр, обследование, при необходимости лечение в короткий временной период, санитарно-гигиеническую обработку. Из него больных транспортируют в лечебно-диагностические отделения. В приёмном покое работают врач и медицинская сестра.
Обязанности медицинской сестры
Фактическая неэффективность вакцинации
Более того, сегодня существуют эпидемии инфекционных заболеваний, но они взяли другую форму - латентную и хроническую - но не менее опасную. Если вакцинация рассматривается как фактор предотвращения инфекционных заболеваний, важно спросить: сколько еще десятилетий будет использоваться медицинским обслуживанием для заражения детей полиомиелитом, корью, краснухой и паротитом? Люди, вакцинированные живыми микроорганизмами, являются потенциальным источником новых инфекций.
В свете знаний об иммунной системе человека, возможно, что те, кто был вакцинирован, стали резервуарами патогенов. Ева Бернатовска в своем последнем, приглашающем издании. Точно так же, если дети вакцинируются в течение десятков лет, согласно теории уничтожения микробов путем вакцинации, эти бактерии уже должны вымирать, и все же это не так. Аналогичным образом, в Западной Европе туберкулез в настоящее время является растущей проблемой. Микобактериальная туберкулезная инфекция активируется у людей в состоянии рефрактерного иммунитета.
Оформление истории болезни на каждого поступающего больного (заполняет титульный лист, указывает точное время поступления, диагноз направившего учреждения). Медицинская сестра делает соответствующую запись в журнале поступления больных.
Измерение температуры тела, осмотр кожных покровов и волосистых частей тела больного для выявления педикулёза.
Переменный и сложный мир микробов
Эта бактерия, как внутриклеточный патоген, может выживать в организме человека в течение десятилетий даже в скрытом состоянии. Случайно, благодаря вакцинам, бактерии и патогены не выживают в наших телах. Что касается проблем инфекционных заболеваний, необходимо учитывать большое разнообразие в мире бактерий и вирусов, их огромный потенциал для изменчивости - изменчивость и выдающуюся адаптивность к различным условиям. Систематизация существ, состоящих только из нуклеиновой кислоты, иногда ферментативных белков и оболочек, с учетом вышеупомянутой тенденции к мутации, подвергается высокой нестабильности.
Выполнение назначений врача. Обязанности врача приёмного отделения
Осмотр больного и его обследование.
Заполнение истории болезни, постановка диагноза при поступлении.
Определение необходимости санитарно-гигиенической обработки больного.
Госпитализация в профильное отделение с указанием вида транспортировки.
Возможность мутации вирусов может быть легко проиллюстрирована на примере продвижения почти каждый год новых антигенных вакцин против гриппа. На данный момент есть также сомнения относительно правильности спаривания в одном препарате для инъекции нескольких типов активных вирусов, таких как те, которые вызывают корь, эпидемический паротит и краснуху. В Польше эта вакцина является обязательной для детей в месяц экстракорпоральной жизни. Одна из иностранных фармацевтических компаний предлагает полякам, рядом с обязательной вакцинацией, описанной, в частности. дополнение, содержащее живой вирус четвертого типа в одном флаконе, то есть вирус ветряной оспы.
При отсутствии показаний к госпитализации оказание необходимой амбулаторной медицинской помощи.
Необходимо отметить, что существуют различия при плановой и экстренной госпитализации.
При плановой госпитализации врач должен на основании направления или предварительной записи определить, в какое профильное отделение госпитализировать больного, и выявить отсутствие противопоказаний к госпитализации (инфекционные заболевания, лихорадка неясного происхождения, контакт с инфекционными больными и пр.).
При экстренной госпитализации врач должен сам осмотреть больного, оказать ему необходимую первую помощь, назначить дополнительное обследование, поставить диагноз и направить больного в профильное отделение или на амбулаторное лечение.
Санитарно-гигиеническая обработка
Санитарно-гигиеническая обработка включает следующие мероприятия.
Гигиеническая ванна или душ.
Переодевание больного.
При обнаружении педикулёза проводят специальную обработку: мытьё с мылом под душем, стрижка волос, обработка 50% мыльносольвентовой пастой, дезинфекция, дезинсекция белья, одежды и обуви.
Транспортировка больного
Способ транспортировки врач выбирает в зависимости от тяжести состояния пациента и особенностей заболевания. Возможны три варианта: пешком, на кресле (сидя) и на каталке (лежа).
Лечебно-диагностическое отделение хирургического профиля (хирургическое отделение)
Из приёмного отделения больные попадают в лечебно-диагностическое. Особенности устройства лечебно-диагностических отделений хирургического профиля прежде всего подчинены правилам асептики и антисептики. При планировании многопрофильных больниц учитывают особенности контингента больных, своеобразие оборудования хирургических отделений, предназначенных для обследования и лечения пациентов с определёнными заболеваниями. Кроме общих хирургических, выделяют специализированные отделения (кардиохирургические, урологические, травматологические, нейрохирургические и др.), что позволяет лечить более эффективно и предупредить возможные осложнения.
Особенности постройки и соблюдение санитарных норм. Большинство больниц строят в зелёных, наиболее экологически чистых районах. Хирургические отделения должны располагаться не на нижних этажах, по возможности палаты должны быть на одного или двух человек. На одного больного в стационаре положено не менее 7,5 м 2 площади при высоте помещения не менее 3 м и ширине не менее 2,2 м. Ориентация окон палат и лечебно-диагностических кабинетов хирургического отделения любая, но соотношение площади окон и пола должна составлять 1:6-1:7. Температура воздуха в палатах должна быть в пределах 18-20 ?С, а влажность 50-55%.
Устройство. В хирургическом отделении должны быть оборудованы палаты для больных, пост палатной медицинской сестры, процедурный кабинет, чистая и гнойная перевязочные, санитарная комната, лечебные и диагностические кабинеты, кабинеты заведующего
отделением и старшей медицинской сестры, ординаторская, сестринская.
Особенности уборки, мебели. Хирургическое отделение должно быть приспособлено для тщательной многократной уборки, причём обязательно влажной и с применением антисептических средств. Ежедневно утром и вечером проводят влажную уборку помещения. Стены моют и протирают влажной тряпкой 1 раз в 3 дня. Очищают от пыли верхние части стен, потолки, плафоны, протирают оконные и дверные рамы 1 раз в месяц.
В связи с необходимостью частой влажной уборки полы должны быть каменными или заливными, либо покрытыми линолеумом или кафелем. Стены выложены плиткой или покрашены краской. В операционной и перевязочной такие же требования предъявляют и к потолкам. Мебель обычно бывает изготовлена из металла или пластмассы, она должна быть лёгкой, без сложной конфигурации поверхностей, иметь колёсики для передвижения. Количество мебели следует максимально ограничить в соответствии с потребностями.
Пропускной режим. В хирургическом отделении не может быть постоянного свободного присутствия посетителей. Кроме того, необходимо контролировать их внешний вид, одежду, состояние.
Проветривание. В отделениях существует график проветривания по- мещений, что значительно (до 30%) снижает обсеменённость воздуха.
Спецодежда. Использование спецодежды в отделении обязательно. Раньше это всегда ассоциировалось с белыми халатами, что во многих учреждениях сохранилось до сих пор. Все работники должны иметь сменную обувь, халаты или специальные костюмы из лёг- кой ткани, регулярно проходящие стирку. Оптимально использование санпропускников: сотрудники, приходя на работу, принимают душ, снимают с себя повседневную одежду и надевают костюмы (халаты). Выход в спецодежде за пределы отделения запрещён. В перевязочной, процедурном кабинете, операционной, послеоперационных палатах и отделении реанимации необходимо ношение колпаков. Ношение колпаков обязательно и для постовых медицинских сестёр, выполняющих различные процедуры у постели больного (инъекции, забор крови на анализ, постановка горчичников, дренажей и пр.).
Операционный блок
Операционный блок - наиболее чистое, «святое» место хирургического стационара. Именно в операционном блоке необходимо наи-
более строгое соблюдение правил асептики. Прошли времена, когда операционная находилась прямо в отделении. Операционный блок всегда должен располагаться отдельно, а в некоторых случаях его даже выносят в специальные пристройки, соединённые переходом с основным больничным комплексом.
Устройство операционного блока, принцип зональности Для предотвращения загрязнённости воздуха в непосредственной близости от операционной раны при организации операционного блока соблюдают принцип зональности. Существует четыре зоны стерильности в операционной.
Зона абсолютной стерильности.
Зона относительной стерильности.
Зона ограниченного режима.
Зона общего больничного режима (нестерильная). Основные помещения операционной и их распределение по зонам стерильности представлены на рис. 2-2.
Порядок работы
Основной принцип в работе операционного блока - строжайшее соблюдение правил асептики. В связи с этим выделяют разные виды операционных: плановые и экстренные, чистые и гнойные. При составлении расписания операций в каждой операционной их порядок определяют в соответствии со степенью инфицированности: от менее инфицированной к более инфицированной.
В операционной не должно быть ненужной мебели и техники, до минимума сокращают объём движений и хождений, вызывающих воз- никновение турбулентных потоков воздуха.
Важным считают ограничение разговоров. В покое за 1 ч человек выделяет 10-100 тыс микробных тел, а при разговоре - до 1 млн. В операционной не должно быть лишних людей. После операции количество микроорганизмов в 1 м 3 воздуха возрастает в 3-5 раз, а при присутствии, например, группы студентов из 5-6 человек - в 20-30 раз. Поэтому для просмотра операций устраивают специальные колпаки, используют систему видеотехники.
Виды уборки операционной
В операционной, как и в перевязочной, существует несколько видов уборки.
В начале рабочего дня - вытирание пыли с горизонтальных поверхностей, подготовка стерильного стола и необходимых инструментов.
Текущая - периодическое удаление во время операции использованного перевязочного материала и белья из тазов, поме-

Рис. 2-2. Планировка операционного блока
щение резецированных органов в специальные ёмкости и вынос их из операционной, постоянный контроль за чистотой помещения и устранение возникающих загрязнений: вытирание пола, столов и пр.
После каждой операции - вынос из операционной всех отработанных материалов, протирание операционного стола раствором антисептика, смена белья, освобождение бросалок, при необходимости
Мытьё пола, горизонтальных поверхностей, подготовка инструментов и стерильного столика для следующей операции.
В конце рабочего дня - дополнительно к предыдущему пункту обязательно проводят мытьё полов и горизонтальных поверхностей, выносят весь перевязочный материал и бельё, включают бактерицидные лампы.
Генеральная - 1 раз в неделю операционный зал или перевязочную моют с использованием антисептических растворов, обрабатывают все поверхности: пол, стены, потолки, лампы; передвижное оборудование вывозят и обрабатывают в другом помещении, а после уборки устанавливают на рабочее место.
Разделение потоков больных
Разделение «чистых» и «гнойных» больных - основной принцип асептики. Применение всех самых современных способов профилак- тики инфекции будет сведено на нет, если в одной палате чистый пос- леоперационный больной будет лежать рядом с гнойным!
В зависимости от мощности стационара существуют разные способы решения этой проблемы.
При наличии в больнице только одного хирургического отделения в нём специально выделяют палаты для гнойных больных, должно быть две перевязочные: чистая и гнойная, причём гнойная должна располагаться в том же отсеке, что и палаты для гнойных больных. Желательно также выделить палату для послеоперационных больных
В противоположной части отделения.
Если в больнице несколько хирургических отделений, их разделяют на чистые и гнойные. В масштабе крупных городов возможно даже разделение стационаров на чистые и гнойные. При этом при госпитализации больных врач скорой помощи знает, какие чистые и какие гнойные стационары по оказанию экстренной хирургической помощи сегодня дежурят, и в соответствии с характером заболевания решает, куда везти больного.
Методы борьбы с инфекцией в воздухе
Какими же методами можно уничтожить микроорганизмы в воздухе или предотвратить их попадание туда? Это ношение масок, использование бактерицидных ламп и вентиляции, соблюдение личной гигиены больными и медицинским персоналом.
Ношение масок
Маски использует медицинский персонал для уменьшения выделения при дыхании капель секрета из носоглотки и ротовой полости во внешнюю среду. Существует два типа масок: фильтрующие и от- ражающие.
К фильтрующим прежде всего относятся марлевые маски. Трёх- слойные марлевые маски, закрывающие нос и рот, задерживают 70% выдыхаемых микроорганизмов, четырёхслойные - 88%, шестислойные - 96%. Однако, чем больше слоёв, тем хирургу труднее дышать. При увлажнении марли фильтрующая способность маски падает. Через 3 ч 100% трёхслойных марлевых масок обильно обсеменено микрофлорой. Для придания маскам большего эффекта их пропитывают антисептиком (например, хлоргексидином), высушивают и автоклавируют. Свойства таких масок сохраняются 5-6 ч. Современные одноразовые маски из целлюлозы обычно эффективны в течение 1 ч.
В отражающих масках конденсат из выдыхаемого воздуха стекает по стенкам маски в специальные ёмкости. Оперировать в таких масках трудно, сейчас их практически не используют.
Ношение масок обязательно в операционной (причём каждый раз
Новой стерильной маски) и перевязочной, при эпидемии гриппа
В палатах, в части случаев - в послеоперационной палате. Маски необходимо использовать при выполнении любых манипуляций, связанных с нарушением покровных тканей (перевязка в палате, катетеризация сосудов и т.д.).
Бактерицидные лампы
Существуют специальные лампы, излучающие ультрафиолетовые лучи с определённой длиной волны, обладающие максимальным бак- терицидным эффектом. Подобные лучи вредны для человека. Поэтому лампы имеют определённую защиту. Кроме того, существует режим их работы - режим кварцевания (лампы включают в помещении, где в это время нет персонала и пациентов). Одна бактерицидная лампа в течение 2 ч стерилизует до 30 м 3 воздуха и уничтожает микроорганизмы на открытых поверхностях. Бактерицидные лампы обязательно должны быть в операционных, перевязочных, процедурных кабинетах, послеоперационных палатах и палатах для гнойных больных.
Вентиляция
Проветривание и вентиляция помещений на 30% снижают загрязнённость воздуха микроорганизмами. Если при этом дополнительно используют кондиционеры с бактериальными фильтрами, эффективность этих мероприятий возрастает до 80%. В особо «чистых» местах, например, в операционных, вентиляция должна быть приточной.
Личная гигиена больных и медицинского персонала
При поступлении больные проходят через санпропускник в при- ёмном отделении (санобработка, переодевание одежды, контроль на педикулёз). Затем пациенты должны соблюдать правила личной ги- гиены. Тяжёлым больным в этом помогают медицинские сёстры (умывание, обработка полости рта, бритьё, перестилание постели). Постельное и нательное бельё нужно менять каждые 7 дней.
В хирургическом отделении существуют определённые правила, касающиеся медперсонала. Прежде всего, это контроль соблюдения правил личной гигиены, отсутствия простудных и гнойничковых за- болеваний. Кроме того, 1 раз в 3 мес персонал проходит обследование на носительство стафилококка в носоглотке. При положительном результате анализа сотрудника отстраняют от работы, в течение 3-4 дней он закапывает в нос антисептик (хлоргексидин), регулярно проводит полоскания зева, после чего у него повторно берут мазок из носоглотки.
Понятие о сверхчистых операционных, барооперационных, палатах с абактериальной средой
В части случаев развитие инфекции после операции особенно опасно. Прежде всего это касается пациентов после трансплантации органов, получающих иммуносупрессивные препараты, а также ожо- говых больных, имеющих огромную площадь входных ворот для инфекции. Для таких случаев существуют сверхчистые операционные, барооперационные и палаты с абактериальной средой. Сверхчистые операционные с ламинарным током воздуха Через потолок операционной постоянно нагнетают стерильный воздух, прошедший через бактериальный фильтр. В пол вмонтировано устройство, забирающее воздух. Так создаётся постоянное ламинарное (прямолинейное) движение воздуха, препятствующее вихревым потокам, поднимающим пыль и микроорганизмы с нестерильных поверхностей (рис. 2-3).

Рис. 2-3. Операционная с ламинарным током воздуха (схема): 1 - фильтр; 2 - направление тока воздуха; 3 - вентилятор; 4 - разграничитель потоков воздуха; 5 - отверстие для наружного воздуха; б - отверстия в полу
Барооперационные
Барооперационные - барокамеры с повышенным давлением, приспособленные для выполнения хирургических операций. Они имеют особые преимущества: повышенная стерильность, улучшение оксигенации тканей. В этих операционных хирург одет в специальный герметичный костюм, а на голове у него - аппарат для дыхания по замкнутому контуру (вдох и выдох осуществляются с помощью специальных трубок извне). Таким образом, персонал полностью изо- лирован от воздуха операционной.
Самый крупный бароцентр расположен в Москве. Но сейчас такой подход считают экономически нецелесообразным, так как стро- ительство и содержание барооперационных очень дороги, а условия работы в них тяжёлые.
Палаты с абактериальной средой
Такие палаты используют в ожоговых центрах и отделениях трансплантации. Их особенность - наличие бактериальных фильтров, через которые осуществляется нагнетание стерильного воздуха с соблюдением принципа ламинарного движения. В палатах поддерживают относительно высокую температуру (22-25 ?С), а также низкую влажность (до 50%).
Профилактика контактной инфекции
Профилактика контактной инфекции, по существу, сводится к осуществлению одного из главных принципов асептики: «Всё, что со- прикасается с раной, должно быть стерильно».
Что же соприкасается с раной?
Хирургические инструменты.
Перевязочный материал и хирургическое бельё.
Руки хирурга.
Операционное поле (кожа самого больного).
Общие принципы и способы стерилизации
Стерилизация (sterilis - бесплодный, лат.) - полное освобождение какого-либо предмета от микроорганизмов и их спор путём воздействия на него физическими или химическими факторами.
Стерилизация - основа асептики. Методы и средства стерилизации должны обеспечивать гибель всех, в том числе высокоустойчивых, микроорганизмов (как патогенных, так и непатогенных). Наиболее устойчивы споры микроорганизмов. Поэтому возможность применения для стерилизации определённых средств оценивают наличием у них спороцидной активности, проявляемой в приемлемые сроки.
Используемые в практике методы и средства стерилизации должны обладать следующими свойствами:
Уничтожать микроорганизмы и их споры;
Быть безопасными для больных и медицинского персонала;
Не ухудшать рабочие свойства изделий.
В современной асептике используют физические и химические методы стерилизации.
Выбор того или иного способа стерилизации зависит, прежде всего, от свойств изделия. Основными считают физические методы стерилизации.
Физические методы стерилизации
К физическим методам относят термические способы - стерилизацию паром под давлением (автоклавирование), стерилизацию горячим воздухом (сухим жаром), а также лучевую стерилизацию.
Стерилизация паром под давлением (автоклавирование)
При этом способе стерилизации действующим агентом служит горячий пар. Стерилизацию просто текучим паром в настоящее время не используют, так как температура пара в обычных условиях (100 ?С) не достаточна для уничтожения всех микробов.
В автоклаве (аппарат для стерилизации паром под давлением) возможно нагревание воды при повышенном давлении (рис. 2-4). Это повышает точку кипения воды и соответственно температуру пара до 132,9 ?С (при давлении 2 атм).
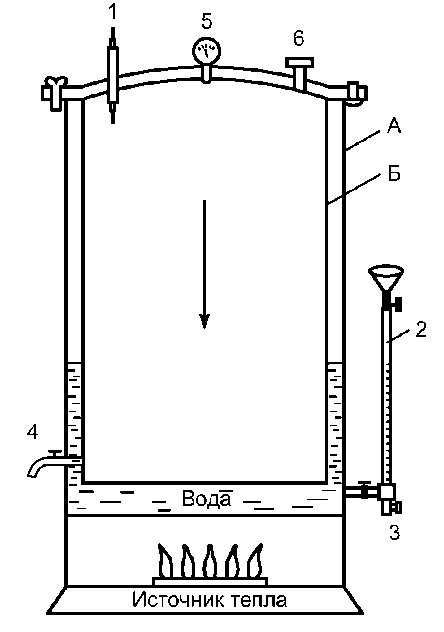
Рис. 2-4. Автоклав (схема). Аи Б - наружная и внутренняя стенки автоклава; 1 - термометр; 2 - водомерное стекло; 3 - впускной кран; 4 - выпускной кран; 5 - манометр; 6 - предохранительный клапан
Хирургические инструменты, перевязочный материал, бельё и другие материалы загружают в автоклав в специальных металлических коробках - биксах Шиммельбуша (рис. 2-5). Биксы имеют боковые отверстия, которые перед стерилизацией открывают. Крышку бикса плотно закрывают.
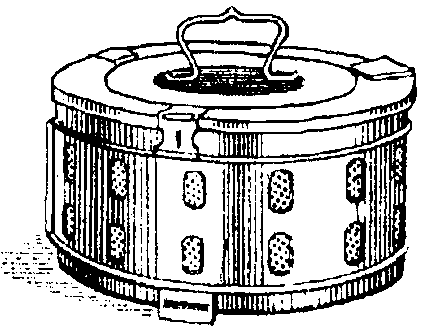
Рис. 2-5. Бикс Шиммельбуша
После загрузки биксов автоклав закрывают герметичной крышкой и проводят необходимые манипуляции для начала его ра- боты в определённом режиме.
Работу автоклава контролируют при помощи показателей манометра и термометра. Существует три режима стерилизации:
При давлении 1,1 атм (t = 119,6 ?С) - 1 ч;
При давлении 1,5 атм (t = 126,8 ?С) - 45 мин;
При давлении 2 атм (t = 132,9 ?С) - 30 мин.
По окончании стерилизации биксы некоторое время остаются в горячем автоклаве для просушки при немного приоткрытой дверце. При извлечении биксов из автоклава закрывают отверстия в стенках биксов и отмечают дату стерилизации (обычно на прикреплённом к биксу кусочке клеёнки). Закрытый бикс сохраняет стерильность находящихся в нём предметов в течение 72 ч.
Стерилизация горячим воздухом (сухим жаром)
Действующим агентом при этом способе стерилизации служит нагретый воздух. Стерилизацию осуществляют в специальных аппаратах - сухожаровых шкафах-стерилизаторах (рис. 2-6).
Инструменты укладывают на полки шкафа-стерилизатора и сначала высушивают в течение 30 мин при температуре 80 ?С с приоткрытой дверцей. Стерилизацию осуществляют при закрытой дверце в течение 1 ч при температуре 180 ?С. После этого при остывании шкафа-стери- лизатора до 60-70 ?С дверцу приоткрывают, при окончательном остывании разгружают камеру со стерильным инструментарием.
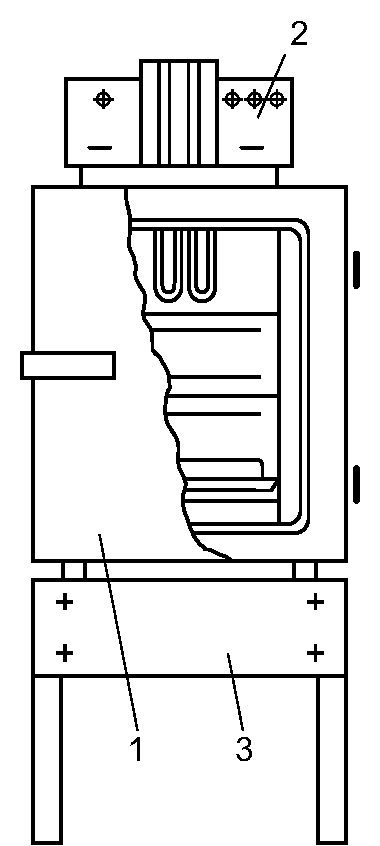
Рис. 2-6. Сухожаровой шкаф-стерилизатор (схема): 1 - кор- пус, 2 - пульт управления с термометрами и терморегуляторами; 3 - подставка
Стерилизация в автоклаве и сухожаровом шкафу в настоящее время стала главным, наиболее надёжным способом стерилизации хи- рургических инструментов.
В современных стационарах обычно выделяют специальные центральные стерилизационные отделения, где с помощью этих двух методов стерилизуют наиболее простые и часто используемые предметы и инструменты всех отделений больницы (шприцы, иглы, простые хирургические наборы, зонды, катетеры и пр.).
Лучевая стерилизация
Антимикробную обработку можно осуществить с помощью ионизирующего излучения (γ-лучи), ультрафиолетовых лучей и ультразвука. Наибольшее применение в наше время получила стерилизация γ-лучами. Используют изотопы Со 60 и Cs 137 . Доза проникающей радиации должна быть весьма значительной - до 20-25 мкГр, что требует соблюдения строгих мер безопасности. В связи с этим лучевую стерилизацию проводят в специальных помещениях, это
заводской метод (непосредственно в стационарах её не проводят).
Стерилизацию инструментов и прочих материалов осуществляют в герметичных упаковках, при целостности последних стериль- ность сохраняется до 5 лет. Благодаря герметичной упаковке удобно хранить и использовать инструменты (необходимо просто вскрыть упаковку). Метод выгоден для стерилизации несложных одноразовых инструментов (шприцев, шовного материала, катетеров, зондов, систем для переливания крови, перчаток и пр.) и получает всё более широкое распространение. Во многом это объясняется тем, что при лучевой стерилизации не изменяются свойства стерилизуемых объектов.
Химические методы стерилизации
К химическим методам относят газовую стерилизацию и стерилизацию растворами антисептиков.
Газовая стерилизация
Газовую стерилизацию осуществляют в специальных герметичных камерах. Стерилизующими агентами служат пары формалина (на дно камеры кладут таблетки формальдегида) или окись этилена. Инструменты, уложенные на сетку, считают стерильными через 6-48 ч (в зависимости от компонентов газовой смеси и температуры в камере). Отличительная особенность метода - его минимальное отрицательное влияние на качество инструментария, поэтому способ используют прежде всего для стерилизации оптических, особо точных и дорогостоящих инструментов.
В настоящее время всё большее распространение находит способ стерилизации в озоново-воздушной камере. Она состоит из генера- тора озона и рабочей части, куда помещают стерилизуемые предметы. Активным агентом служит озон, который смешивается с воздухом. В камере поддерживают температуру 40 ?С. Время стерилизации 90 мин. Преимущество этого метода состоит в его надёжности, быстроте, сохранении всех свойств обрабатываемых материалов и абсолютной экологической безопасности. В отличие от лучевой стерилизации, метод используют непосредственно в стационарах.
Стерилизация растворами антисептиков
Стерилизацию растворами химических антисептиков так же, как лучевую и газовую стерилизацию, относят к холодным способам стерилизации. Она не приводит к затуплению инструментов, в связи с чем её прежде всего применяют для обработки режущих хирургических инструментов.
Для стерилизации чаще используют 6% раствор перекиси водорода. При замачивании в перекиси водорода инструменты считаются стерильными через 6 ч.
Стерилизация хирургических инструментов
Обработка всех инструментов включает последовательное выполнение двух этапов: предстерилизационной обработки и собственно стерилизации. Способ стерилизации прежде всего зависит от вида ин- струментов.
Предстерилизационная подготовка
Предстерилизационная подготовка складывается из обеззараживания, мытья и высушивания. Ей подвергают все виды инструментов.
Вид и объём предстерилизационной обработки в недавнем прошлом зависел от степени инфицированности инструментов. Так, раньше существенно отличалась обработка инструментов после чистых операций (перевязок), гнойных операций, операций у больных, перенёсших гепатит и относимых к группе риска по СПИДу. Однако в настоящее время, учитывая высокую опасность распространения ВИЧ-инфекции, правила предстерилизационной подготовки ужес- точены и приравнены к способам обработки инструментов, предусматривающим безусловную гарантию уничтожения ВИЧ. Следует отметить, что инструменты после гнойных операций, операций у больных, перенёсших в течение последних 5 лет гепатит, а также при риске ВИЧ-инфекции обрабатывают отдельно от других.
Все процедуры предстерилизационной обработки обязательно выполняют в перчатках!
Обеззараживание
Непосредственно после использования инструменты погружают в ёмкость с дезинфицирующими средствами (накопитель). При этом они должны быть полностью погружены в раствор. В качестве дезинфицирующих средств используют 3% раствор хлорамина (экспозиция 40- 60 мин) или 6% раствор перекиси водорода (экспозиция 90 мин). После обеззараживания инструменты промывают проточной водой.
Мытьё
Инструменты погружают в специальный моющий (щелочной) раствор, в его состав входят моющее средство (стиральный порошок), пероксид водорода и вода. Температура раствора 50-60 ?С, экспозиция 20 мин. После замачивания инструменты моют щётками в том же растворе, а затем - в проточной воде.
Высушивание можно осуществлять естественным путём. В последнее время, особенно при последующей стерилизации горячим воздухом, инструменты сушат в сухожаровом шкафу при температуре 80 ?С в течение 30 мин. После высушивания инструменты готовы к стерилизации.
Собственно стерилизация
Выбор метода стерилизации в первую очередь зависит от вида хирургических инструментов.
Все хирургические инструменты можно условно разделить на три группы:
Металлические (режущие и нережущие);
Резиновые и пластмассовые;
Оптические (рис. 2-7).
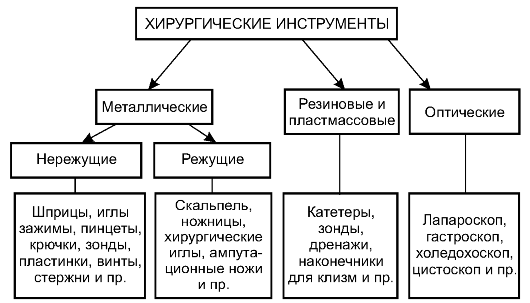
Рис. 2-7. Основные виды хирургических инструментов
Стерилизация нережущих металлических инструментов
Основной метод стерилизации нережущих металлических инструментов - стерилизация горячим воздухом в сухожаровом шкафу или автоклаве при стандартных режимах. Некоторые виды простых инст- рументов (пинцеты, зажимы, зонды и др.), предназначенные для одноразового использования, можно стерилизовать лучевым способом.
Стерилизация режущих металлических инструментов
Проведение стерилизации режущих инструментов с помощью термических методов приводит к их затуплению и потере необходимых свойств. Основной метод стерилизации режущих инструментов - холодный химический способ с применением растворов антисептиков.
Самыми лучшими способами стерилизации считают газовую стерилизацию (в озоново-воздушной камере) и лучевую стерилизацию в заводских условиях. Последний метод получил распространение при использовании одноразовых лезвий для скальпеля и хирургических игл (атравматический шовный материал).
Стерилизация резиновых и пластмассовых инструментов
Основной метод стерилизации резиновых изделий - автоклавирование. При многократной стерилизации резина теряет свои элас- тические свойства, трескается, что признано некоторым недостатком метода. Пластмассовые изделия разового использования, а также катетеры и зонды подвергают лучевой заводской стерилизации.
Особо следует сказать о стерилизации перчаток. В последнее время наиболее часто используют одноразовые перчатки, подвергшиеся лучевой заводской стерилизации. При многократном использовании основным методом стерилизации становится автоклавирование в щадящем режиме: после предстерилизационной обработки перчатки высушивают, пересыпают тальком (предупреждает слипание), заворачивают в марлю, укладывают в бикс. Автоклавируют при 1,1 атм в течение 30-40 мин, при 1,5 атм - 15-20 мин.
После надевания стерильных перчаток обычно их обрабатывают марлевым шариком со спиртом для снятия с поверхности талька или других веществ, препятствовавших слипанию резины.
В экстренных случаях для стерилизации перчаток возможен следующий приём: хирург надевает перчатки и в течение 5 мин обрабатывает их тампоном, смоченным 96% этиловым спиртом.
Стерилизация оптических инструментов
Основной метод стерилизации оптических инструментов, требующих щадящей обработки с исключением нагревания, - газовая стерилизация. Этим способом обрабатывают все инструменты для проведения лапароскопических и торакоскопических вмешательств, что связано со сложным их устройством.
При стерилизации фиброгастроскопов, холедохоскопов, колоноскопов возможно применение и холодной стерилизации с использованием химических антисептиков (хлоргексидина).
Следует особо отметить, что наилучшим способом профилактики контактной инфекции признано использование одноразового инструментария, подвергшегося лучевой заводской стерилизации!
Стерилизация перевязочного материала и белья Виды перевязочного материала и операционного белья
К перевязочному материалу относят марлевые шарики, тампоны, салфетки, бинты, турунды, ватно-марлевые тампоны. Перевязочный материал обычно готовят непосредственно перед стерилизацией, используя специальные приёмы для предотвращения осыпания отдельных нитей марли. Для удобства подсчёта шарики укладывают по 50- 100 штук в марлевые салфетки, салфетки и тампоны связывают по 10 штук. Перевязочный материал повторно не используют, после применения его уничтожают.
К операционному белью относят хирургические халаты, простыни, полотенца, подкладные. Материалом для их изготовления слу-
жат хлопчатобумажные ткани. Операционное бельё многократного применения после использования проходит стирку, причём отдель- но от других видов белья.
Стерилизация
Перевязочный материал и бельё стерилизуют автоклавированием при стандартных режимах. Перед стерилизацией перевязочный материал и бельё укладывают в биксы. Существует три основных вида укладки бикса: универсальная, целенаправленная и видовая укладки.
Универсальная укладка. Обычно используют при работе в перевязочной и при малых операциях. Бикс условно разделяют на секторы, каждый из них заполняют определённым видом перевязочного материала или белья: в один сектор помещают салфетки, в другой - шарики, в третий - тампоны и т.д.
Целенаправленная укладка. Предназначена для выполнения типичных манипуляций, процедур и малых операций. Например, укладка для трахеостомии, катетеризации подключичной вены, перидуральной анестезии и пр. В бикс укладывают все инструменты, перевязочный материал и бельё, необходимые для осуществления процедуры.
Видовая укладка. Обычно используют в операционных, где необходимо большое количество стерильного материала. При этом в один бикс, например, укладывают хирургические халаты, в другой - простыни, в третий - салфетки и т.д.
В небольшом количестве используют перевязочный материал в упаковках, прошедший лучевую стерилизацию. Существуют и специальные наборы операционного белья одноразового использования (халаты и простыни), изготовленного из синтетических тканей, также подвергшихся лучевой стерилизации.
Обработка рук хирурга
Обработка (мытьё) рук хирурга - очень важная процедура. Существуют определённые правила мытья рук.
Классические методы обработки рук Спасокукоцкого-Кочерги- на, Альфельда, Фюрбрингера и другие имеют лишь исторический интерес, их в настоящее время не применяют.
Современные методы обработки рук хирурга
Обработка рук хирурга состоит из двух этапов: мытья рук и воздействия антисептическими средствами.
Мытьё рук. Применение современных способов предполагает пер- воначальное мытьё рук с мылом или с помощью жидких моющих средств (при отсутствии бытового загрязнения рук).
Воздействие антисептических средств. Используемые для обработки рук химические антисептики должны иметь следующие свойства:
Обладать сильным антисептическим действием;
Быть безвредными для кожи рук хирурга;
Быть доступными и дешёвыми (так как их применяют в больших объёмах).
Современные способы обработки рук не требуют специального дубления (используют плёнкообразующие антисептики или антисеп- тики с элементом дубления).
Руки тщательно обрабатывают от кончиков пальцев до верхней трети предплечья. При этом соблюдают определённую последователь- ность, в основе которой лежит принцип - не касаться обработанными участками рук менее чистой кожи и предметов.
Основными современными средствами обработки рук служат первомур, хлоргексидин, дегмин (дегмицид), церигель, АХД, евросепт и пр.
Обработка рук первомуром
Первомур (предложен в 1967 г. Ф.Ю. Рачинским и В.Т. Овсипяном) - смесь муравьиной кислоты, перекиси водорода и воды. При соединении компонентов образуется надмуравьиная кислота - мощный антисептик, вызывающий образование тончайшей плён- ки на поверхности кожи, закрывающей поры и исключающей необходимость дубления. Используют 2,4% раствор, приготовленный ex temporo.
Методика: мытьё рук проводят в тазах в течение 1 мин, после чего руки высушивают стерильной салфеткой. Преимущество метода - его быстрота. Недостаток: возможно развитие дерматита на руках хирурга.
Обработка рук хлоргексидином
Используют 0,5% спиртовой раствор хлоргексидина, что исключает необходимость дополнительного воздействия спиртом с целью дубления, а также высушивания вследствие быстрого испарения спиртового раствора.
Методика: руки дважды обрабатывают тампоном, смоченным антисептиком, в течение 2-3 мин. Относительный недостаток метода - его длительность.
Обработка дегмином и дегмицидом
Эти антисептики относят к группе поверхностно-активных веществ (детергентов).
Методика: обработку проводят в тазах в течение 5-7 мин, после чего руки высушивают стерильной салфеткой. Недостаток метода - его длительность.
Обработка АХД, АХД-специаль, евросептом
Действующим началом этих комбинированных антисептиков служит этанол, эфир полиольной жирной кислоты, хлоргексидин.
Методика: препараты находятся в специальных флаконах, из них при нажатии на специальный рычаг определённая доза препаратов выливается на руки хирурга, и он втирает раствор в кожу рук в течение 2-3 мин. Процедуру повторяют дважды. В дополнительном дублении и высушивании нет необходимости. Метод практически ли- шён недостатков, в настоящее время его считают самым прогрессивным и распространённым.
Несмотря на существующие способы обработки рук, в настоящее время все операции и манипуляции при контакте с кровью больного хирурги должны выполнять только в стерильных перчатках!
При необходимости выполнения небольших манипуляций или в критических ситуациях допускают надевание стерильных перчаток без предшествующей обработки рук. При выполнении обычных хирургических операций так делать нельзя, так как любое повреждёние перчатки может привести к инфицированию операционной раны.
Обработка операционного поля
Предварительно проводят санитарно-гигиеническую обработку (мытьё в ванне или под душем, смену постельного и нательного белья). В день операции сбривают волосяной покров в области операционного поля (сухое бритьё). На операционном столе операционное поле обрабатывают химическими антисептиками (органическими йодсодержащими препаратами, хлоргексидином, первомуром, АХД, стерильными клеящимися плёнками). При этом соблюдают следующие правила:
Широкая обработка;
Последовательность «от центра - к периферии»;
Загрязнённые участки обрабатывают в последнюю очередь;
Многократность обработки в ходе операции (правило Филончи- кова-Гроссиха): обработку кожи выполняют перед отграничением
стерильным бельём, непосредственно перед разрезом, а также перед наложением кожных швов и после него.
Правила подготовки к выполнению операции
Кроме знания основ обработки рук хирурга, операционного поля, стерилизации инструментов и т.д., необходимо соблюдать определён- ную последовательность действий перед началом любой хирургической операции. Обычно подготовку к хирургическому вмешательству проводят следующим образом.
Первой к операции готовится операционная сестра. Она переодевается в специальный операционный костюм, надевает бахилы, колпак и маску. Затем в предоперационной она проводит обработку рук по одному из указанных выше способов, после чего входит в операционную, открывает бикс со стерильным бельём (пользуясь специальной ножной педалью для открывания крышки бикса) и надевает на себя стерильный халат, одновременно попадая обеими руками в его рукава, не касаясь при этом ни халатом, ни руками посторонних предметов, что может привести к нарушению стерильности. После этого сестра завязывает на рукавах халата завязки, а сзади халат завязывает санитар, его руки нестерильны, поэтому он может касаться только внутренней поверхности халата и той его части, которая оказывается на спине сестры и в последующем считается нестерильной.
Вообще в течение всей операции стерильным считают халат сестры и хирурга спереди до пояса. Стерильные руки нельзя поднимать выше плеч и опускать ниже пояса, что связано с возможностью нару- шения стерильности при неосторожных движениях.
После облачения в стерильную одежду сестра надевает стерильные перчатки и накрывает стерильный стол для выполнения вмешательства: малый (или большой) операционный столик покрывают четырьмя слоями стерильного белья, затем на него в определённой последовательности выкладывают необходимые для операции стерильные инструменты и перевязочный материал.
Хирург и ассистенты переодеваются и обрабатывают руки аналогичным образом. После этого один из них получает из рук сестры длинный инструмент (обычно корнцанг) с салфеткой, смоченной антисептиком, и производит обработку операционного поля, несколько раз меняя салфетку с антисептиком. Затем сестра надевает на хирурга и ассистента стерильные халаты, набрасывая их на вытянутые стерильные руки, и завязывает завязки на запястьях. Сзади халаты завязывает санитар.
После облачения в стерильные халаты хирурги ограничивают операционное поле стерильным хирургическим бельём (простынями, подкладными или полотенцами), закрепляя его специальными бельевыми зажимами или цапками. Сестра надевает на руки хирургов стерильные перчатки. Ещё раз проводят обработку кожи и выполняют разрез, то есть начинают проведение хирургической операции.
Способы контроля стерильности
Все действия по обработке и стерилизации инструментов, белья и прочего подлежат обязательному контролю. Контролируют как эффективность стерилизации, так и качество предстерилизационной подготовки.
Контроль стерильности
Методы контроля стерильности делят на прямой и непрямые. Прямой метод
Прямой метод контроля стерильности - бактериологическое исследование: специальной стерильной палочкой проводят по стерильным инструментам (коже рук хирурга или операционного поля, опе- рационному белью и пр.), после чего помещают её в стерильную пробирку и отправляют в бактериологическую лабораторию, где проводят посев на различные питательные среды и таким образом определяют бактериальную загрязнённость.
Бактериологический метод контроля стерильности наиболее точен. Отрицательный момент - длительность проведения исследования: результат посева бывает готов лишь через 3-5 сут, а использо- вать инструменты нужно непосредственно после стерилизации. Поэтому бактериологическое исследование проводят в плановом порядке и по его результатам судят о методических погрешностях в работе медицинского персонала или дефектах используемого оборудования. По существующим нормативам, несколько различающимся для разного вида инструментария, бактериологическое исследование необходимо проводить 1 раз в 7-10 дней. Кроме того, 2 раза в год подобные исследования во всех подразделениях больницы проводят районные и городские санитарно-эпидемиологические службы.
Непрямые методы
Непрямые методы контроля используют в основном при термических способах стерилизации. С их помощью можно определить величину температуры, при которой проводили обработку, не давая точ-
ный ответ на вопрос о присутствии или отсутствии микрофлоры. Преимущество непрямых методов в быстроте получения результата и возможности их использования при каждой стерилизации.
При автоклавировании в бикс обычно укладывают ампулу (пробирку) с порошкообразным веществом, имеющим температуру плав- ления в пределах 110-120 ?С. После стерилизации при открытии бикса сестра прежде всего обращает внимание на эту ампулу: если вещество расплавилось, то материал (инструменты) можно считать стерильными, если же нет - нагревание было недостаточным и пользоваться таким материалом нельзя, так как он нестерилен. Для подобного метода наиболее часто используют бензойную кислоту (температура плавления 120 ?С), резорцин (температура плавления 119 ?С), антипирин (температура плавления 110?С). Вместо ампулы в бикс можно поместить термоиндикатор или максимальный термометр, по которому также можно определить, какова была температура во время обработки.
Аналогичные непрямые способы используют при стерилизации в сухожаровом шкафу. Однако здесь применяют вещества с более вы- сокой температурой плавления (аскорбиновая кислота - 190 ?С, янтарная кислота - 190 ?С, тиомочевина - 180 ?С), другие термоиндикаторы или термометры.
Контроль качества предстерилизационной обработки
Для контроля качества предстерилизационной обработки используют химические вещества, с помощью которых можно обнаружить на инструментах следы неотмытой крови или остатки моющих средств. Реактивы обычно изменяют свой цвет в присутствии соответствующих веществ (крови, щелочных моющих средств). Методы используют после проведения обработки перед стерилизацией.
Для обнаружения так называемой скрытой крови наиболее часто применяют бензидиновую пробу.
Для выявления следов моющих веществ используют кислотно-щелочные индикаторы, наиболее распространена фенолфталеиновая проба.
Профилактика имплантационной инфекции
Имплантация - внедрение, вживление в организм больного искусственных, чужеродных материалов и приспособлений с опреде- лённой лечебной целью.
Особенности профилактики имплантационной инфекции
Профилактика имплантационной инфекции - обеспечение строжайшей стерильности всех предметов, внедряемых в организм больного. В отличие от контактного пути распространения инфекции, при имплантационном отмечают практически 100% контагиозность. Оставаясь в организме больного, где существуют благоприятные условия (температура, влажность, питательные вещества), микроорганизмы долго не погибают и часто начинают размножаться, вызывая нагноение. При этом внедрённое в организм инородное тело в последующем длительно поддерживает воспалительный процесс. В части случаев происходит инкапсуляция колоний микроорганизмов, которые не погибают и могут стать источником вспышки гнойного процесса через месяцы или годы. Таким образом, любое имплантированное тело - возможный источник так называемой дремлющей инфекции.
Источники имплантационной инфекции
Что же хирурги «оставляют» в организме больного? Прежде всего шовный материал. Без этого не обходится практически ни одно вмешательство. В среднем во время полостной операции хирург накла- дывает около 50-100 швов.
Вероятным источником имплантационной инфекции становятся дренажи - специальные трубки, предназначенные для оттока жид- костей, реже воздуха (плевральный дренаж) или предназначенные для введения лекарств (катетеры). Учитывая этот путь распространения инфекции, существует даже понятие «катетерный сепсис» (сепсис - тяжёлое общее инфекционное заболевание, см. главу 12).
Кроме шовного материала и дренажей, в организме больного остаются протезы клапанов сердца, сосудов, суставов и т.д., различные металлические конструкции (скобки, скрепки из шовных аппаратов, винты, спицы, шурупы и пластинки для остеосинтеза), специальные приспособления (кава-фильтры, спирали, стенты и пр.), синтетическая сетка, гомофасция, а иногда и трансплантированные органы.
Все имплантаты, безусловно, должны быть стерильны. Способ стерилизации зависит от того, из какого материала они выполнены. Многие протезы имеют сложную конструкцию и строгие специальные правила стерилизации. Если резиновые дренажи и катетеры можно стерилизовать в автоклаве или кипятить, то некоторые изделия из пластмассы, а также из разнородных материалов следует стерилизовать с помощью химических методов (в растворах антисептиков или газовом стерилизаторе).
В то же время сейчас основным, практически наиболее надёжным и удобным методом признана заводская стерилизация γ-лучами.
Основным вероятным источником имплантационной инфекции остаётся шовный материал, постоянно используемый хирургами.
Стерилизация шовного материала
Виды шовного материала
Шовный материал неоднороден, что связано с разными его функциями. В одном случае наиболее важна прочность нитей, в другом - их рассасывание со временем, в третьем - инертность по отношению к окружающим тканям и т.д. Во время операции хирург для каждого конкретного шва выбирает самый подходящий вид нити. Существует достаточное разнообразие видов шовного материала.
Шовный материал естественного и искусственного происхождения
К шовному материалу естественного происхождения относят шёлк, хлопчатобумажную нить и кетгут. Происхождение первых двух видов общеизвестно. Кетгут изготавливают из подслизистого слоя кишки крупного рогатого скота. Шовный материал искусственного происхождения в настоящее время представлен огромным количеством нитей, созданных из синтетических химических веществ: капрон, лавсан, фторлон, полиэстер, дакрон и пр.
Рассасывающийся и нерассасывающийся шовный материал
Рассасывающиеся нити используют для сшивания быстро срастающихся тканей в тех случаях, когда не нужна высокая механичес- кая прочность. Таким материалом сшивают мышцы, клетчатку, слизистые оболочки органов желудочно-кишечного тракта, жёлчных и мочевых путей. В последнем случае наложение рассасывающихся швов позволяет избежать образования конкрементов вследствие оседания солей на лигатурах. Классический пример рассасывающегося шовного материала - кетгут. Кетгутовые нити полностью рассасываются в организме через 2-3 нед. Удлинения сроков рассасывания, а также увеличения прочности кетгута достигают импрегнацией нитей металлами (хромированный кетгут, реже - серебряный кетгут), в этом случае сроки рассасывания увеличиваются до 1-2 мес.
К синтетическим рассасывающимся материалам относят дексон, викрил, оксцилон. Сроки их рассасывания примерно такие же, как у хромированного кетгута, но они обладают повышенной прочностью, что позволяет использовать более тонкие нити.
Все остальные нити (шёлк, капрон, лавсан, полиэстер, фторлон и пр.) называют нерассасывающимися - они остаются в организме больного на всю жизнь (кроме снимаемых кожных швов).
Шовный материал с различным строением нити
Различают плетёный и кручёный шовный материал. Плетёный труднее изготавливать, но он более прочен. В последнее время успехи химии привели к возможности использования нити в виде моноволокна, обладающего высокой механической прочностью при малом диаметре. Именно мононити применяют в микрохирургии, косметической хирургии, при операциях на сердце и сосудах.
Травматический и атравматический шовный материал
В течение многих лет во время хирургической операции операционная сестра непосредственно перед наложением шва вдевала соот- ветствующую нить в разъёмное ушко хирургической иглы. Такой шовный материал в настоящее время называют травматическим.
В последние десятилетия широкое распространение получил атравматический шовный материал. Нить в заводских условиях прочно соединена с иглой и предназначена для наложения одного шва. Основное преимущество атравматического шовного материала - примерное соответствие диаметра нити диаметру иглы (при использовании травматического материала толщина нити значительно меньше диаметра ушка иглы), таким образом, нить практически полностью закрывает собой дефект в тканях после прохождения иглы. В связи с этим именно атравматический шовный материал необходимо использовать при сосудистых и косметических швах. Учитывая также остроту одноразовых игл и удобство в работе, следует полагать, что в ближайшее время атравматический шовный материал постепенно полностью вытеснит травматический.
Толщина нитей
Для удобства в работе всем нитям в зависимости от их толщины присвоены номера. Самая тонкая нить имеет?0, самая толстая - ?10. При общехирургических операциях обычно используют нити
от?1 до?5. Нить?1, например, можно использовать для прошивания или перевязки мелких сосудов, наложения серо-серозных швов на стенку кишки. Нити?2 и 3 - для перевязки сосудов сред- него калибра, наложения серозно-мышечных швов на кишку, ушивания брюшины и пр. Нить?5 обычно применяют для сшивания апоневроза.
При выполнении сосудистых операций, особенно микрохирургических вмешательств, необходимы ещё более тонкие нити, чем нить?0. Таким нитям стали присваивать??1/0, 2/0, 3/0 и т.д. Самая тонкая нить, используемая сейчас в офтальмологии и при операциях на лимфатических сосудах, имеет?10/0. Следует отметить, что нити отличаются и по другим свойствам: одни лучше скользят и склонны к развязыванию, другие пружинят при натяжении, более или менее инертны по отношению к тканям, более или менее прочны и т.д.
В последнее время получили распространение нити, обладающие антимикробной активностью за счёт введения в их состав антисептиков и антибиотиков (летилан-лавсан, фторлон и др.).
Несколько особняком стоят металлические скрепки, клеммы, клипсы, изготавливаемые из нержавеющей стали, титана, тантала и других сплавов.
Этот вид шовного материала используют в специальных сшивающих аппаратах.
Способы стерилизации шовного материала
В настоящее время основной способ стерилизации шовного материала - лучевая стерилизация в заводских условиях. Это в полной мере касается атравматического шовного материала: иглу с нитью по- мещают в отдельную герметичную упаковку, на которой указаны размеры, кривизна и вид (колющая или режущая) иглы, материал, длина и номер нити. Шовный материал стерилизуют, затем он в упаковке поступает в лечебные учреждения.
Также можно стерилизовать и просто нити. Кроме того, отрезки нитей можно поместить в герметичные стеклянные ампулы со специальным антисептическим раствором, а катушки с нитями - в специальные герметичные контейнеры с таким же раствором.
Классические способы стерилизации шёлка (метод Кохера) и кетгута (метод Ситковского в парах йода, методы Губарева и Клаудиуса в спиртовом и водном растворах Люголя) в настоящее время запрещены для использования из-за их длительности, сложности и не всегда достаточной эффективности.
Стерилизация конструкций, протезов, трансплантатов
Способ стерилизации имплантатов целиком зависит от материала, из которого они изготовлены.
Металлические конструкции для остеосинтеза (пластинки, шурупы, винты, спицы) стерилизуют вместе с металлическими нережу- щими инструментами в автоклаве или сухожаровом шкафу.
Более сложные протезы (протезы клапанов сердца, суставов), состоящие не только из металлических, но и из пластмассовых деталей, лучше стерилизовать химическими способами - в газовом стерилизаторе или путём замачивания в растворах антисептиков.
В последнее время ведущие фирмы-производители протезов выпускают их в герметичных упаковках, стерилизованных лучевым методом.
Кроме различных конструкций и протезов, источником имплантационной инфекции могут стать аллогенные органы, изъятые из другого организма при операции трансплантации. Стерилизация трансплантатов невозможна, поэтому при заборе органов необходимо соблюдать строжайшую стерильность: операции забора выполняют с соблюдением тех же правил асептики, что и обычные хирургические вмешательства. После извлечения из организма донора и промывания стерильными растворами орган помещают в специальный герметичный контейнер, где он находится до трансплантации в стерильных условиях.
Эндогенная инфекция и её значение в хирургии
Эндогенной называют инфекцию, источник которой находится в организме самого больного (см. рис. 2-1). Её источники - кожа больного, желудочно-кишечный тракт, ротовая полость, а также очаги ин- фекции при наличии сопутствующих заболеваний. Наиболее частыми из них бывают кариозные зубы, воспалительные заболевания мочевыводящих путей, хронический тонзиллит, аднексит, хронический бронхит.
Из очага инфекции в рану микроорганизмы могут попадать по кровеносным сосудам (гематогенно), по лимфатическим сосудам (лим- фогенно) и непосредственно (контактно).
Профилактика эндогенной инфекции - обязательный компонент современной хирургии. Различают профилактику эндогенной инфекции при плановой и экстренной операциях.
Профилактика при плановой операции
Плановую операцию следует выполнять на максимально благоприятном фоне. Поэтому одна из задач предоперационного периода - выявление возможных очагов эндогенной инфекции. Существует мини- мум обследования, проводимый всем больным, даже самым «крепким», ничем, кроме основного заболевания, раньше не болевшим. Он включает клинический анализ крови, общий анализ мочи, биохимический анализ крови, флюорографию грудной клетки, электрокардиографию, анализ крови на RW (реакция Вассермана - выявляет заболевание сифилисом) и форму 50 (анализ на антитела к ВИЧ), заключение сто- матолога о санации полости рта, для женщин - заключение гинеколога. Если при обследовании выявлен источник эндогенной инфекции (кариес, аднексит и пр.), плановую операцию нельзя выполнять до тех пор, пока воспалительный процесс не будет ликвидирован. В эпидемию гриппа важно следить за тем, чтобы не взять в операционную пациента, находящегося в продромальном периоде. После пере- несённого острого инфекционного заболевания нельзя оперировать в плановом порядке ещё в течение 2 нед после полного выздоровления.
Профилактика перед экстренной операцией
Иная ситуация складывается при оказании экстренной помощи. Здесь полноценное обследование в короткий период времени невозможно, да и в любом случае отменить жизненно необходимую операцию нельзя. Но всё же следует знать о существовании очагов эндогенной инфекции для того, чтобы непосредственно перед операцией и в послеоперационном периоде назначить дополнительное лечение (антибиотики и пр.).
Госпитальная инфекция
Госпитальная инфекция - заболевание или осложнение, развитие которого связано с инфицированием больного, произошедшим во время его нахождения в стационаре.
Госпитальную инфекцию в последнее время называют нозокомиальной (noso - болезнь, komos - приобретение), подчеркивая то, что во всех случаях заболевание или развившееся осложнение развилось в стационаре в результате проведения лечебно-диагностического процесса.
Госпитальная инфекция остаётся важнейшей проблемой хирургии, несмотря на постоянное совершенствование методов асептики и антисептики.
Общая характеристика
Госпитальная инфекция имеет характерные особенности.
Возбудители инфекции устойчивы к основным антибиотикам и антисептическим средствам. Это связано с пассированием микрофлоры в условиях хирургического стационара, где в воздухе, на различных поверхностях, в организме больных присутствуют низкие концентрации антимикробных средств.
Возбудители инфекции - обычно условно-патогенные микроорганизмы, наиболее часто это стафилококк, клебсиеллы, кишечная палочка, proteus vulgaris и пр.
Инфекция возникает у ослабленных в результате болезни или операции пациентов, часто она бывает суперинфекцией.
Часто возникают массовые поражения одним штаммом микроорганизма, проявляющиеся сходной клинической картиной заболевания (осложнения).
Из представленных характеристик ясно, что возникающие заболевания или осложнения бывают тяжёлыми, лечить их сложно. По- этому особое значение имеет профилактика госпитальной инфекции.
Профилактика
Основные меры профилактики госпитальной инфекции:
Сокращение количества предоперационных койко-дней;
Учёт при госпитализации особенностей заполнения палат (в одной палате должны находиться больные с примерно одинаковой длительностью пребывания в стационаре);
Ранняя выписка с контролем на дому;
Смена антисептических средств и антибиотиков, используемых в отделении;
Рациональное назначение антибиотиков;
Желательно закрытие хирургических стационаров на проветривание (1 мес в год); эта мера обязательна для гнойных отделений и при вспышке госпитальной инфекции.
Проблема СПИДа в хирургии
С распространением синдрома приобретённого иммунодефицита (СПИД) хирургия встала перед новыми проблемами. Учитывая, что у хирургических больных есть раны, существует возможность контакта с кровью и другими жидкими средами организма, важнейшей
стала задача предупреждения попадания в больничной среде в организм больного вируса иммунодефицита человека (ВИЧ).
Всю профилактику СПИДа в хирургии можно разделить на четыре самостоятельных направления: выявление вирусоносителей, выявление больных ВИЧ-инфекцией, соблюдение техники безопасности медпер- соналом и изменение правил стерилизации инструментов (рис. 2-8).
![]()
Рис. 2-8. Основные направления профилактики ВИЧ-инфекции в хирургии
Выявление вирусоносителей
Эти мероприятия необходимы для выявления больных хирургического отделения - возможных источников передачи возбудителя. Всех больных, относимых к группе риска (наркоманы, гомосексуалисты; пациенты, переболевшие гепатитом В или С, венерическими заболеваниями и пр.), а также подвергшихся инвазивным методам диагностики и лечения, необходимо обследовать на ВИЧ (анализ крови - форма 50). Кроме того, 1 раз в 6 мес все работники хирургических отделений, операционных блоков, отделений переливания крови, гемодиализа, лабораторий, то есть всех служб, где возможен контакт с кровью больного, сдают кровь на биохимический анализ, анализ на австралийский антиген, RW и форму 50.
Выявление больных СПИДом
Существует комплекс характерных проявлений ВИЧ-инфекции. Для того чтобы не пропустить это заболевание при наличии даже од- ного из представленных на схеме симптомов (см. рис. 2-8), врач всегда обязан провести исследование крови пациента (форма 50). Следует помнить, что два практически абсолютных признака СПИДа - пневмоцистная пневмония и саркома Капоши.
Техника безопасности медперсонала
Первое и самое главное: все манипуляции, при которых возможен контакт с кровью, необходимо выполнять в перчатках!
Это касается забора крови на анализ, инъекций, постановки капельниц, исследований крови в лаборатории, введения зонда, кате- теризации мочевого пузыря и пр. Никаких, даже самых минимальных, операций без перчаток!
Кроме этого, существует перечень определённых мер безопасности. Вот лишь некоторые из них (Приказ?86 от 30.08.89 МЗ СССР):
Ношение специальных масок (очков) во время операции;
При попадании на кожу или слизистую оболочку (конъюнктиву) каких-либо жидкостей больного необходимо провести обработку антисептиками согласно инструкции;
При попадании биологических жидкостей на столы, микроскопы и прочие инструменты их поверхность обязательно подлежит дезинфекции;
Пробирки из лаборатории можно использовать повторно только после стерилизации.
Изменение правил стерилизации инструментов
Во-первых, это максимальное использование одноразовых инструментов, прежде всего шприцев. Запрещено использование систем для внутривенного вливания многократного применения.
Во-вторых, хирургические инструменты после использования перед прохождением обычной предстерилизационной подготовки и последующей стерилизации первоначально необходимо замачивать в сильных антисептиках (дезинфицировать). Для этого можно использовать только 3% раствор хлорамина (замачивание на 60 мин) и 6% раствор перекиси водорода (замачивание на 90 мин).
Антисептика
В отличие от асептики, где основным мерилом эффективности мероприятий считают их мощный бактерицидный эффект, надёжность и длительность стерилизации, в антисептике, когда препараты и методы уничтожают инфекцию внутри живого организма, крайне важно, чтобы они были безвредны, не токсичны для различных органов и систем, не вызывали серьёзных побочных эффектов. Кроме того, используя антисептические методы, можно не просто уничтожать микроорганизмы, а стимулировать различные механизмы в организме больного, направленные на подавление инфекции.
Выделяют виды антисептики в зависимости от природы используемых методов: механическая, физическая, химическая и биологи- ческая антисептика.
В практике обычно сочетают разные виды антисептики. Например, в гнойную рану вводят тампон из марли, способствующий оттоку раневого отделяемого благодаря гигроскопичности материала (физическая антисептика), и смачивают его борной кислотой (химическая антисептика). При плеврите для эвакуации экссудата плевральную полость пунктируют (механическая антисептика), после чего вводят раствор антибиотика (биологическая антисептика). Таких примеров очень много.
Механическая антисептика
Механическая антисептика - уничтожение микроорганизмов механическими методами. Конечно, в буквальном смысле механически удалить микроорганизмы технически невозможно, но можно уда-
лить участки ткани, насыщенные бактериями, инфицированные сгустки крови, гнойный экссудат. Механические методы признаны основными: трудно бороться с инфекцией химическими и биологическими методами, если не удалён очаг инфекции.
На схеме (рис. 2-9) представлены основные мероприятия, относимые к механической антисептике.
Туалет раны
Туалет раны выполняют практически при любой перевязке и в несколько изменённом виде - при оказании первой врачебной помо- щи при случайном ранении.
Во время перевязки снимают пропитанную отделяемым повязку, обрабатывают кожу вокруг раны, снимая при этом отслоившийся эпидермис, следы раневого экссудата, остатки клеола (см. главу 3). При необходимости пинцетом или зажимом с марлевым шариком удаляют гнойный экссудат, инфицированные сгустки, свободно лежащие

Рис. 2-9. Основные мероприятия механической антисептики
некротические ткани и пр. Мероприятия простые, но очень важные. Их соблюдение позволяет ликвидировать около 80-90% микроорга- низмов в ране и вокруг неё.
Первичная хирургическая обработка раны
Следующее и самое важное мероприятие механической антисептики - первичная хирургическая обработка раны. Подробно её этапы, показания и противопоказания к проведению рассмотрены в главе 4.
Первичная хирургическая обработка раны позволяет превратить инфицированную рану в рану стерильную (асептическую) за счёт иссечения краёв, стенок и дна раны вместе с инородными телами и зонами некроза.
Таким образом удаляются все ткани, соприкасавшиеся с нестерильным предметом и внешней средой, в которых могут находиться микроорганизмы. Такой хирургический метод - основной способ лечения инфицированных ран.
Вторичная хирургическая обработка раны
В отличие от первичной, вторичную хирургическую обработку выполняют при наличии уже инфицированной раны. В этом случае манипуляции менее агрессивны: удаляют некротические ткани, представляющие хорошую питательную среду для жизнедеятельности микроорганизмов. Кроме того, необходимо выявить, нет ли в ране углублений, карманов или затёков, из которых затруднено вытекание экссудата. При наличии узкого хода, ведущего к полости с гноем, самостоятельное дренирование бывает обычно недостаточным: полость с гнойным экссудатом увеличивается в размерах, прогрессирует воспалительный процесс. Если же ход рассечь и обеспечить свободный отток гноя, быстро начинается купирование воспалительного процесса.
Другие операции и манипуляции
К антисептическим мероприятиям относят и ряд оперативных вмешательств. Это прежде всего вскрытие гнойников: абсцессов, флегмон и пр. «Uvi pus - ubi es» (видишь гной - выпусти его) - основной принцип гнойной хирургии. Пока не сделан разрез и не эвакуирован гной из очага, никакие антибиотики и антисептики не дадут возможности справиться с заболеванием.
В хирургии не принято называть антисептическими такие операции, как аппендэктомия при остром аппендиците, холецистэктомия при остром холецистите и подобные, хотя, по сути, при них удаляют орган, содержащий огромное скопление микроорганизмов, то есть в какой-то степени их тоже можно считать мерами механической антисептики.
В некоторых случаях эффективна пункция гнойника. Так поступают, например, при гнойном гайморите (пунктируют гайморову пазуху), плеврите (пунктируют плевральную полость). При гнойниках, находящихся в глубине организма, осуществляют пункцию под контролем ультразвукового исследования (УЗИ).
Таким образом, по существу, механическая антисептика - лечение инфекции истинно хирургическим методом, с помощью хирургических инструментов и скальпеля.
Физическая антисептика
Физическая антисептика - уничтожение микроорганизмов с помощью физических методов. Основные из них представлены на рис. 2-10.
Гигроскопичный перевязочный материал
Введение в рану гигроскопичного материала значительно увеличивает объём эвакуированного экссудата. Обычно используют марлю в виде тампонов, шариков и салфеток различных размеров. Кроме того, при- меняют гигроскопическую (белую) вату или ватно-марлевые тампоны.
Существует метод Микулича: в рану укладывают салфетку, к ней привязывают длинную нить, выводимую наружу, всю полость внутри салфетки наполняют шариками. В последующем при перевязках шарики вынима- ют и заменяют новыми, а салфетку держат до конца фазы гидратации.
Введённый в рану марлевый тампон в среднем сохраняет свои свойства «высасывать» раневое отделяемое около 8 ч, а затем пропитывается экссудатом и становится препятствием для оттока. Перевязывать больных 3 раза в сут невозможно, да и не нужно. Поэтому, чтобы тампон не стал обтуратором, его нужно вводить в рану рыхло, чтобы через 8 ч отток отделяемого мог идти мимо самого тампона.
Гипертонические растворы
Для улучшения оттока из раны используют гипертонические растворы - растворы, осмотическое давление действующего вещества кото-
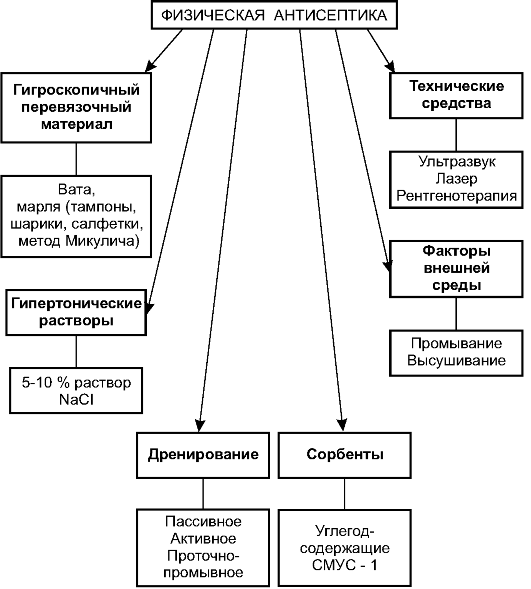
Рис. 2-10. Основные мероприятия физической антисептики
рых выше, чем в плазме крови. Чаще всего используют 10% раствор натрия хлорида (официнальный гипертонический раствор). В детской хирургии применяют 5% раствор натрия хлорида. При смачивании тампонов гипертоническим раствором за счёт разницы осмотического давления отток жидкости из раны происходит более активно.
Дренирование
Крайне важный элемент физической антисептики - дренирование. Этот метод применяют при лечении всех видов ран, после боль-

Рис. 2-11. Виды дренирования: а - пассивное; б - активное; в - проточно-промывное
шинства операций на грудной и брюшной полостях, он основан на свойствах капиллярности и сообщающихся сосудов.
Различают три основных вида дренирования: пассивное, активное и проточно-промывное (рис. 2-11).
Пассивное дренирование
Для пассивного дренирования используют полоски перчаточной резины, так называемый «сигарообразный дренаж» (когда внутрь резиновой перчатки или её пальца вводят тампон, смоченный антисеп- тиком), резиновые и полихлорвиниловые трубки. В последнее время широкое применение нашли двухпросветные трубки: по ним в силу законов капиллярности отток жидкости происходит активнее. При пассивном дренировании отток идёт по принципу сообщающихся сосудов, поэтому дренаж должен находиться в нижнем углу раны, а второй свободный его конец - ниже раны.
На дренаже обычно дополнительно делают несколько боковых отверстий (на случай закупорки основного). Для предотвращения смещения дренажей их следует фиксировать к коже специальными швами. Самопроизвольное выпадение дренажной трубки из раны нежелательно (нарушается процесс дренирования). Однако ещё более опасна миграция дренажа внутрь, особенно в грудную или брюшную полость, что требует впоследствии достаточно сложных мероприятий.
Наружный конец дренажа либо оставляют в повязке, либо опускают во флакон с антисептиком или специальный герметичный полиэтиленовый пакет (чтобы отделяемое не стало источником экзогенной инфекции для других больных).
Активное дренирование
При активном дренировании в области наружного конца дренажа создают отрицательное давление. Для этого к дренажам прикрепляют специальную пластмассовую гармошку, резиновый баллончик или электрический отсос. Активное дренирование возможно при герметичности раны, когда на неё на всём протяжении наложены кожные швы.
Проточно-промывное дренирование
При проточно-промывном дренировании в рану устанавливают не меньше двух дренажей. По одному (или нескольким) из них посто- янно в течение суток осуществляют введение жидкости (лучше антисептического раствора), а по другому (другим) она вытекает.
Введение жидкости в дренаж осуществляют наподобие внутривенных капельных вливаний. Способ очень эффективен и позволяет в части случаев зашивать наглухо даже инфицированные раны, что впоследствии ускоряет процесс заживления. Важно следить за тем, чтобы в ране не было задержки жидкости: количество оттекающей жидкости должно быть равно количеству введённой. Подобный метод можно использовать при лечении перитонита, тогда его называют перитонеальным диализом. Если, кроме антисептика, в рану вводят протеолитические ферменты, такой метод называют проточным ферментативным диализом. Это ещё один из примеров смешанной антисептики - сочетание физического, химического и биологического методов.
Сорбенты
В последнее время всё чаще применяют сорбционный способ лечения ран: в рану вводят вещества, адсорбирующие токсины и микроорганизмы. Обычно это углеродсодержащие вещества в виде порошка или волокон. Наиболее часто используют лигнин гидролизный и различные угли, предназначенные для гемосорбции и гемодиализа, например СМУС-1.
Факторы внешней среды
В лечении ран с целью борьбы с микроорганизмами можно использовать и факторы внешней среды. Наиболее распространены промывание и высушивание раны.
При промывании раны вместе с раствором выводятся участки некротических тканей, инородные тела, вымывается гнойный экссудат.
Раны можно промыть обильно смоченным тампоном, шприцем или вводя жидкость через дренаж. Большинство гнойных ран промывают во время перевязок. Метод постоянного промывания раны (про- точно-промывное дренирование) был описан ранее.
Высушивание ран (больные находятся в палатах с высокой температурой воздуха и малой влажностью) обычно применяют при ожо- гах. На ранах при этом образуется струп - своеобразная биологическая повязка, и микроорганизмы гибнут под воздействием факторов местного иммунитета.
Технические средства
Использование технических средств - важный раздел современной физической антисептики.
Ультразвук
Ультразвук используют при лечении гнойных ран. В рану наливают раствор антисептика и вводят в неё наконечник прибора с низкочастотными ультразвуковыми колебаниями. Метод называют ультразвуковой кавитацией раны. Колебания жидкости способствуют улучшению микроциркуляции в стенках раны, отторжению некротических тканей. Кроме того, происходит ионизация воды, а ионы водорода и гидроксил-ионы нарушают окислительно-восстановительные процессы в микробных клетках.
Лазер
Лазерное излучение малой мощности (обычно используют газовый углекислый лазер) активно применяют в гнойной хирургии. Бактерицидное действие на стенки раны обеспечивает успех операций в тех случаях, когда обычно развивается гнойный процесс.
Ультрафиолетовые лучи
Бактерицидное действие ультрафиолетового облучения (УФО) используют для уничтожения микроорганизмов на раневой поверхности: облучают область раны, трофических язв и т.д.
В последнее время лазерное излучения и УФО используются для облучения крови как экстракорпорально, так и внутри сосудов. Для этого созданы специальные аппараты, однако эти методы уместнее отнести к биологической антисептике, так как здесь основную роль играет не бак- терицидное действие, а стимуляция защитных сил организма больного.
Рентгенотерапия
Рентгеновское излучение применяют для подавления инфекции в небольших, глубоко расположенных очагах, Так можно лечить костный панариций и остеомиелит, воспаление после операций в брюшной полости и др.
Химическая антисептика
Химическая антисептика - уничтожение микроорганизмов в ране, патологическом очаге или организме больного и в среде вокруг него с помощью различных химических веществ. Химическая антисептика получила широкое распространение в хирургии. Создают, производят и с успехом применяют огромное количество препаратов, обладающих бактерицидной активностью.
Классификация антисептиков
по назначению и способу применения
Выделяют дезинфицирующие средства, антисептические вещества наружного применения и химиотерапевтические средства.
Дезинфицирующие средства используют в асептике для обработки инструментов, мытья стен, полов, обработки предметов ухода и пр.
Антисептические вещества применяют наружно для обработки кожи, рук хирурга, промывания ран и слизистых оболочек.
Химиотерапевтические средства вводят внутрь, они оказывают резорбтивное действие в организме больного, подавляя рост бактерий в различных патологических очагах.
Основные группы химических антисептиков
Разделение антисептиков по химическому строению традиционно и наиболее удобно. Выделяют 16 групп химических антисептиков.
1. Группа галоидов
Йод - 1-5% спиртовая настойка, антисептическое средство наружного применения. Используют для обработки кожи вокруг раны при перевязке, для обработки ссадин, царапин, поверхностных ран. Обладает выраженным дубящим действием.
Йод + калия йодид - 1% раствор, «синий йод». Антисептик для наружного применения: для промывания ран, полоскания зева.
Повидон-йод - органическое соединение йода (0,1 - 1% свободного йода). Антисептическое средство наружного применения. Используют для обработки кожи при перевязках и операциях, а также для обработки ран (аэрозоль).
Раствор Люголя содержит йод и йодид калия. Можно использовать водный и спиртовой растворы. Препарат комбинированного действия. Как дезинфицирующее средство применяют для стерилизации кетгута, как химиотерапевтическое средство - для лечения заболеваний щитовидной железы.
Хлорамин Б - 1-3% водный раствор. Дезинфицирующее средство. Используют для дезинфекции предметов ухода, резиновых инструментов, помещений.
2. Соли тяжёлых металлов
Сулема - в концентрации 1:1000 для дезинфекции перчаток, пред- метов ухода, как этап в стерилизации шёлка. В настоящее время в связи с токсичностью её практически не применяют.
Оксицианид ртути - дезинфицирующее средство. В концентрации 1:10 000, 50 000 пригоден для стерилизации оптических инструментов.
Нитрат серебра - антисептическое средство наружного применения. В виде 0,1-2,0% раствора используют для промывания конъюнктивы и слизистых оболочек. 5-20% растворы обладают выраженным прижигающим действием и служат для обработки избыточных грануляций, ускорения рубцевания пупка у новорождённых и пр.
Серебра протеинат - антисептическое средство наружного применения, обладает вяжущим действием. Используют для смазывания слизистых оболочек, промывания мочевого пузыря при воспалительном процессе в нём.
Оксид цинка - антисептическое средство наружного применения. Входит в состав многих присыпок и паст, обладающих противовоспалительным эффектом, предотвращает развитие мацерации кожи.
3. Спирты
Этиловый спирт - дезинфицирующее средство (стерилизация шовного материала, обработка инструментов) и антисептическое средство наружного применения (обработка рук хирурга и операционного поля, краёв раны при перевязках, для компрессов и пр.). 70% спирт обладает антисептическим действием, а 96% - ещё и дубящим. В настоящее время широкое применение для обработки рук хирурга
и хирургических инструментов нашли препараты АХД-2000 (активные вещества - этанол и эфир полиольной жирной кислоты) и АХД-2000-специаль (в состав дополнительно входит хлоргексидин).
4. Альдегиды
Формалин - 37% раствор формальдегида. Сильное дезинфицирующее средство. 0,5-5,0% растворы используют для дезинфекции перчаток, дренажей, инструментов. Эффективен против эхинококка. Применяют также при фиксации препаратов для гистологического исследования. В сухом виде пригоден для стерилизации в газовых стерилизаторах, в частности, оптических инструментов.
Лизол - сильное дезинфицирующее средство. 2% раствор служит для дезинфекции предметов ухода, помещений, замачивания загряз- нённых инструментов. В настоящее время практически не применяют из-за высокой токсичности.
5. Красители
Бриллиантовый зелёный - антисептическое средство наружного применения. 1-2% спиртовой (или водный) раствор используют для обработки поверхностных ран и ссадин слизистой оболочки полости рта и кожи.
Метилтиониния хлорид - антисептическое средство наружного применения. 1-2% спиртовой (или водный) раствор служит для обработки поверхностных ран и ссадин слизистой оболочки полости рта и кожи, 0,02% водный раствор - для промывания ран.
6. Кислоты
Борная кислота - антисептическое средство наружного применения. 2-4% раствор - один из основных препаратов для промывания и лечения гнойных ран. Можно использовать в виде порошка, входит в состав присыпок и мазей.
Салициловая кислота - антисептическое средство наружного применения. Обладает кератолитическим действием. Применяют в виде кристаллов (для лизиса тканей), входит в состав присыпок, мазей.
7. Щёлочи
Нашатырный спирт - антисептическое средство наружного применения. Раньше 0,5% раствор использовали для обработки рук хирурга (метод Спасокукоцкого-Кочергина).
8. Окислители
Пероксид водорода - антисептическое средство наружного применения. 3% раствор - основной препарат для промывания гнойных ран при перевязках. Свойства: антисептик (активный агент - атомарный кислород), гемостатик (способствует остановке кровотечения), дезодорант, вызывает пенообразование, улучшающее очищение раны. Входит в состав первомура (средства для обработки рук хирурга и операционного поля). 6% раствор перекиси водорода - дезин- фицирующее вещество.
Перманганат калия - антисептическое средство наружного применения. 2-5% раствор используют для лечения ожогов и пролежней (обладает коагулирующим и дубящим действиями). 0,02-0,1% раствором промывают раны и слизистые оболочки. Имеет выраженный дезодорирующий эффект.
9. Детергенты (поверхностно-активные вещества)
Хлоргексидин - антисептическое средство наружного применения. 0,5% спиртовой раствор пригоден для обработки рук хирурга и операционного поля. 0,1-0,2% водный раствор - один из основных препаратов для промывания ран и слизистых оболочек, лечения гнойных ран. Входит в состав растворов для обработки рук и операционного поля (пливасепт, АХД-специаль).
«Астра» «Новость» - компоненты моющих растворов для дезинфекции инструментов.
10. Производные нитрофурана
Нитрофурал - антисептическое средство наружного применения. Раствор 1:5000 - один из основных препаратов для лечения гнойных ран, промывания ран и слизистых оболочек.
«Лифузоль» - содержит нитрофурал, линетол, смолы, ацетон (аэро- золь). Антисептическое средство наружного применения. Наносится в виде плёнки. Применяют для защиты послеоперационных ран и дренажных отверстий от экзогенной инфекции, а также для лечения поверхностных ран.
Нитрофурантоин, фуразидин, фуразолидон - химиотерапевтические средства, так называемые «уроантисептики». Кроме терапии инфекций мочевыводящих путей, используют при лечении кишечных инфекций.
11. Производные 8-оксихинолина
Нитроксолин - химиотерапевтическое средство, уроантисептик. Применяют при инфекциях мочевыводящих путей.
Лоперамид, аттапулгит - химиотерапевтические средства, применяемые при кишечных инфекциях.
12. Производные хиноксалина
Гидроксиметилхиноксилиндиоксид - антисептическое средство наружного применения. 0,1 - 1,0% водный раствор используют для промывания гнойных ран, слизистых оболочек, особенно при неэффективности антибиотиков и других антисептиков. При сепсисе и тяжёлых инфекциях можно вводить и внутривенно капельно.
13. Дёгти, смолы
Дёготь берёзовый - антисептическое средство наружного применения. Входит как компонент в состав мази Вишневского, используемой при лечении гнойных ран (кроме антисептического действия, стимулирует рост грануляций).
Ихтаммол - используют в виде мазей, обладает противовоспали- тельным действием.
14. Производные нитроимидазола
Метронидазол - средство широкого спектра действия. Эффективен в отношении простейших, бактероидов и части анаэробов.
15. Антисептики растительного происхождения
Хлорофиллипт, эктерицид, бализ, календула - в основном используют как антисептические средства наружного применения для промывания поверхностных ран, слизистых оболочек, обработки кожи. Обладают противовоспалительным эффектом.
16. Сульфаниламиды
Сульфаниламидные препараты - химиотерапевтические средства, оказывающие бактериостатическое действие. Служат для подавления различных очагов инфекции в организме, обычно таблетированные препараты. Входят также в состав мазей и присыпок для наружного применения. Таблетированные препараты имеют различный срок действия: от 6 ч до 1 сут.
Сульфаниламид, сульфаэтидол, сульфадимидин - короткого действия.
Сульфагуанидин - среднего срока действия.
Сульфален - длительного действия.
Ко-тримоксазол - комбинированный препарат, в его состав входят сульфаниламид и производное диаминопиримидина - триметоприм. Весьма распространённое лекарственное средство для лечения различных воспалительных процессов.
Биологическая антисептика
Виды биологической антисептики
В отличие от видов антисептики, рассмотренных ранее, биологическая антисептика - не просто биологические методы уничтожения микроорганизмов. Биологическую антисептику разделяют на два вида:
Биологическая антисептика прямого действия - использование фармакологических препаратов биологического происхождения, непосредственно воздействующих на микроорганизмы;
Биологическая антисептика опосредованного действия - использование фармакологических препаратов и методов различного происхождения, стимулирующих способности макроорганизма в борьбе с микроорганизмами.
Основные фармакологические препараты и методы
Основные препараты и методы биологической антисептики представлены в табл. 2-1.
Протеолитические ферменты
Протеолитические ферменты сами не уничтожают микроорганизмы, но лизируют некротические ткани, фибрин, разжижают гнойный экссудат, оказывают противовоспалительное действие.
Трипсин, химотрипсин - препараты животного происхождения, их получают из поджелудочной железы крупного рогатого скота.
Террилитин - продукт жизнедеятельности плесневого грибка Aspergillis terricola.
Ируксол - мазь для ферментативного очищения; комбинированный препарат, в состав которого входят фермент клостридилпепти- даза и антибиотик хлорамфеникол.
Применение ферментов для лечения гнойных ран и трофических язв позволяет быстрее добиться их очищения от некротических тка-
Таблица 2-1. Основные препараты и методы биологической антисептики
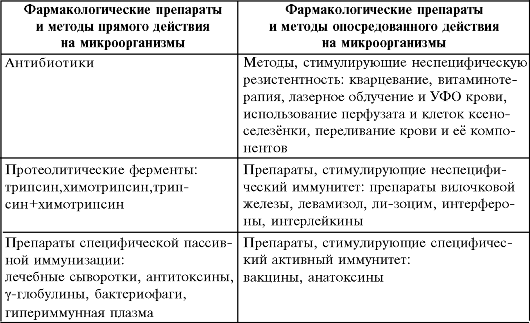
ней, насыщенных микробами; такие ткани становятся для патогенных микроорганизмов хорошей питательной средой. В ряде случаев, по существу, производится некрэктомия без применения скальпеля.
Препараты для пассивной иммунизации
Из препаратов пассивной иммунизации наиболее часто используют следующие.
Противостолбнячная сыворотка и противостолбнячный γ-глобулин - для профилактики и лечения столбняка. Противогангренозную сыворотку применяют для профилактики и лечения анаэробной инфекции.
В арсенале хирургов существуют антистафилококковый, антистрептококковый и антиколи-бактериофаги, а также поливалентный бактериофаг, содержащий несколько вирусов, способных репродуцироваться в бактериальной клетке и вызывать её гибель. Бактериофаги используют местно для промывания и лечения гнойных ран и полостей после идентификации возбудителя.
Антистафилококковая гипериммунная плазма - нативная плазма доноров, иммунизированных стафилококковым анатоксином. Назначают при различных хирургических заболеваниях, вызванных стафилокок- ком. Используют также антисинегнойную гипериммунную плазму.
Методы стимуляции неспецифической резистентности
К методам стимуляции неспецифической резистентности относят такие простые мероприятия, как кварцевание, витаминотерапия и даже полноценное питание, так как все они улучшают функции иммунной системы.
Более сложными методиками признаны УФО и лазерное облучение крови. Методы приводят к активации фагоцитоза и системы комплемента, улучшают функцию переноса кислорода и реологические свойства крови, что также важно для купирования воспалительного процесса. Эти способы применяют как в острой фазе инфекционного процесса, так и для профилактики рецидивов, например, при роже и фурункулёзе.
В последнее время всё большее применение в клинике находят препараты ксеноселезёнки (селезёнки свиньи). При этом используют свойства содержащихся в ней лимфоцитов и цитокинов. Возможна пер- фузия через цельную или фрагментированную селезёнку. Существуют методики приготовления ксеноперфузата и взвеси клеток селезёнки.
Важным методом стимуляции иммунной системы служит переливание крови и её компонентов, прежде всего плазмы и взвеси лим- фоцитов. Однако эти способы используют только при тяжёлых инфекционных процессах (сепсисе, перитоните и пр.).
Препараты, стимулирующие неспецифический иммунитет
К лекарственным веществам, стимулирующим неспецифический иммунитет, относят препараты вилочковой железы. Их получают из вилочковой железы крупного рогатого скота. Они регулируют соотношение Т- и В-лимфоцитов, стимулируют фагоцитоз.
Левамизол в основном стимулирует функции лимфоцитов, лизоцим усиливает бактерицидную активность крови. Но в последнее время вместо них стали использовать интерфероны и интерлейкины, обладающие более целенаправленным воздействием на иммунную систему. Особенно эффективны новые препараты интерферон аль- фа-2а, интерлейкин-2 и интерлейкин-1b, полученные методом генной инженерии.
Препараты, стимулирующие специфический иммунитет
Из препаратов для стимуляции активного специфического иммунитета в хирургии наиболее часто используют стафилококковый и столбнячный анатоксины.
Антибиотики
Антибиотики - вещества, являющиеся продуктом жизнедеятельности микроорганизмов, подавляющие рост и развитие определён- ных групп других микроорганизмов. Это важнейшая группа фармакологических препаратов, используемых для лечения и профилактики хирургической инфекции.
История антибиотиков начинается в XIX веке. В 1871 г. профессор Санкт-Петербургской Военно-медицинской академии В.А. Монассеин описал способность плесневых грибов подавлять развитие бактерий. В 1872 г. А.Г. Полотебнов сообщил о положительном результате применения плесени для лечения гнойных ран, а чуть позже И.И. Мечников, исследуя явление фагоцитоза, впервые предположил возможность использования сапрофитных бактерий для уничтожения патогенных микроорганизмов.
В 1896 г. итальянский врач Б. Гозио выделил из культуры грибка Penicillium микофеноловую кислоту, оказывающую бактериостатическое действие на возбудителя сибирской язвы. Это был фактически первый в мире антибиотик, но широкого применения он не получил. В начале XX века были выделены антибиотики из культуры синегнойной палочки, но их эффект был непостоянен, вещества были нестойкими. Далее наступила «эра пенициллина».
В 1913 г. американцы Альсберг и Блэк выделили из грибка рода Penicillium антимикробное вещество - пенициллиновую кислоту, но производство и клиническое применение препарата не состоялось изза мировой войны. В 1929 г. англичанин Флеминг вырастил грибок Penicillium notatum, способный уничтожать стрептококки и стафилококки, а в 1940 г. группа учёных Оксфордского университета во главе с Говардом Флори выделила из этого грибка в чистом виде вещество, названное ими пенициллином. В 1943 г. в США впервые было начато промышленное производство антибиотика пенициллина.
Первый отечественный пенициллин был получен в 1942 г. академиком З.В. Ермольевой из грибка Penicillium crustosum, продуктив- ность которого была выше английского.
Появление пенициллина вызвало настоящую революцию в хирургии, да и в медицине вообще. После нескольких инъекций препарата поправлялись больные, ещё недавно обречённые. Казалось, что все виды заболеваний, вызываемых микроорганизмами, побеждены. У медиков началась некоторая эйфория, но вскоре выяснилось, что многие штаммы микроорганизмов устойчивы к пенициллину, при- чём эти штаммы стали выявлять всё чаще и чаще.
Учёные стали открывать новые группы антибиотиков. В 1939 г. Дюбо получил грамицидин. В 1944 г. Шатц, Буги и Ваксман выделили стрептомицин, что позволило резко снизить смертность от тубер- кулёза. В 1947 г. Эрлих получил хлорамфеникол. В 1952 г. Мак Гупре - эритромицин. В 1957 г. Умизава - канамицин. В 1959 г. Сенен - рифампицин. В 50-х годах в лаборатории Г. Флори был получен первый антибиотик из грибка Cephalosporum, положивший начало большой группе современных антибиотиков - цефалоспоринов. Однако со всеми антибиотиками была отмечена аналогичная картина - всё чаще начинали образовываться резистентные к ним штаммы бактерий. В последние десятилетия созданы новые группы антибиотиков, более эффективных в борьбе с современной хирургической инфекцией (фторхинолоны, карбапенемы, гликопептиды).
Основные группы антибиотиков
Ниже представлены основные группы антибиотиков. В скобках указаны механизм и спектр действия, возможные осложнения. I. Бета-лактамы
1. Пенициллины (ингибируют синтез клеточной стенки, в основном широкий спектр действия):
полусинтетические: оксациллин, ампициллин, амоксициллин;
пролонгированные: бензатина бензилпенициллин, бензатина бензилпенициллин + бензилпенициллин прокаина + бензилпенициллин, бензатина бензилпенициллин + бензилпенициллин прокаина;
комбинированные: амлициллин + оксациллин, амоксициллин + клавулановая кислота, ампициллин + сульбактам.
Клавулановая кислота и сульбактам - ингибиторы пенициллиназы, синтезируемой микроорганизмами.
2. Цефалоспорины (нарушают синтез клеточной стенки, широкий спектр действия, нефротоксичны в высоких дозах):
I поколение: цефалексин, цефазолин;
II поколение: цефамандол, цефокситин, цефаклор, цефуроксим;
III поколение: цефтриаксон, цефотаксим, цефиксим, цефтазидим;
IV поколение: цефепим.
3. Карбопенемы (нарушение синтеза клеточной стенки, широкий спектр действия):
Меропенем;
комбинированный: имипенем + целастатин натрия. Целастатин - ингибитор фермента, влияющего на метаболизм антибиотика в почках.
4. Монобактамы (нарушают синтез клеточной стенки, широкий спектр действия):
II. Другие
5. Тетрациклины (подавляют функции рибосом микроорганизмов, широкий спектр действия):
Тетрациклин;
полусинтетические: доксициклин.
6. Макролиды (нарушают синтез белка в микроорганизмах, гепатотоксичны, воздействие на желудочно-кишечный тракт):
Эритромицин, олеандомицин, азитромицин, кларитромицин.
7. Аминогликозиды (нарушают синтез клеточной стенки, широкий спектр действия, ото- и нефротоксичны):
I поколение: стрептомицин, канамицин, неомицин;
II поколение: гентамицин;
III поколение: тобрамицин, сизомицин;
полусинтетические: амикацин, нетилмицин.
8. Левомицетины (нарушают синтез белка в микроорганизмах, широкий спектр действия, угнетают гемопоэз):
Хлорамфеникол.
9. Рифампицины (нарушают синтез белка в микроорганизмах, широкий спектр действия, вызывают гиперкоагуляцию, гепатотоксичны):
Рифампицин.
10. Противогрибковые:
Леворин, нистатин, амфотерицин В, флуконазол.
11. Полимиксин В (воздействует на грамотрицательные микроорганизмы, в том числе на сингнойную палочку).
12. Линкозамины (нарушают синтез белка в микроорганизмах):
Линкомицин, клиндамицин (в анаэробной среде).
13. Фторхинолоны (подавление ДНК-гиразы микроорганизмов, широкий спектр действия):
III поколение: норфлоксацин, офлоксацин, ципрофлоксацин, пефлоксацин, энофлоксацин;
IV поколение: левофлоксацин, спарфлоксацин.
14. Гликопептиды: (изменяют проницаемость и биосинтез клеточной стенки, синтез РНК бактерий, широкий спектр действия, обладают нефротоксичностью, влияют на гемопоэз):
Ванкомицин, тейкопланин.
Одни из самых распространённых антибиотиков - бета-лактамные. При контакте с этими антибиотиками некоторые микроорганизмы начинают синтезировать расщепляющий их фермент (пенициллиназа, цефалоспориназа или β-лактамаза 1, 3, 5 и др.).
Наименее часто бактерии синтезируют подобные ферменты на новые препараты последних поколений, что определяет их высокую активность и широкий спектр действия. Кроме того, в антибиотики дополнительно вводят ингибиторы лактамаз (клавулановую кислоту, сульбактам).
Кроме представленной классификации по группам, антибиотики разделяют на препараты широкого и узкого спектров действия.
Выделяют антибиотики первой очереди, или первого ряда (пенициллины, макролиды, аминогликозиды), второй очереди, или второго ряда (цефалоспорины, полусинтетические аминогликозиды, амоксициллин + клавулановая кислота и пр.), и резервные (фторхинолоны, карбапенемы).
Выделяют антибиотики короткого и пролонгированного действия. Так, для поддержания бактерицидной концентрации в плазме крови бензилпенициллин следует вводить каждые 4 ч, а цефтриаксон (цефалоспорин III поколения) - 1 раз в сут.
По токсичности выделяют ото-, нефро-, гепато- и нейротоксичные антибиотики. Существуют антибиотики со строго регламентированной дозой применения (линкозамины, аминогликозиды и пр.) и препараты, дозу которых можно увеличивать в зависимости от выраженности инфекционного процесса (пенициллины, цефалоспорины).
Осложнения антибиотикотерапии
Лечение антибиотиками имеет особенности. Прежде всего это связано с возможностью развития определённых осложнений. Основные осложнения антибиотикотерапии следующие:
Токсическое действие на внутренние органы;
Дисбактериоз;
Формирование устойчивых штаммов микроорганизмов. Аллергические реакции могут иметь типичные проявления: аллергическая сыпь (крапивница), отёк Квинке, нарушение дыхания, бронхоспазм - вплоть до развития анафилактического шока. Относительно большая частота таких осложнений связана с тем, что препараты имеют биологическое происхождение и чаще других вызывают соответствующую реакцию макроорганизма.
Основные варианты токсического действия на внутренние органы указаны в приведённой выше схеме основных групп антибиотиков. Чаще нарушаются слух, функции почек и печени.
Развитие дисбактериоза чаще возникает у детей, а также при длительном применении антибиотиков в высоких дозах, особенно широкого спектра действия.
Наиболее незаметное, но очень неприятное осложнение - формирование устойчивых штаммов микроорганизмов, что приводит к неэффективности последующей антибиотикотерапии этими фармако- логическими препаратами.
Классические принципы рациональной антибиотикотерапии
Особенности лечения антибиотиками связаны с влиянием вида препарата, дозы, кратности введения и длительности его примене- ния на эффективность лечения и возможность развития осложнений. Не последнее значение имеют доступность и стоимость лекарственного средства. Основные классические принципы рациональной антибиотикотерапии следующие:
Применять антибиотики только по строгим показаниям.
Назначать максимальные терапевтические или, при тяжёлых инфекциях, субтоксические дозы препаратов.
Соблюдать кратность введения в течение суток для поддержания постоянной бактерицидной концентрации препарата в плазме крови.
Применять антибиотики курсами с продолжительностью от 5-7 до 14 сут.
При выборе антибиотика основываться на результатах исследования чувствительности микрофлоры.
Менять антибиотик при его неэффективности.
Учитывать синергизм и антагонизм при назначении комбинации антибиотиков, а также антибиотиков и других антибактериальных препаратов.
При назначении антибиотиков обращать внимание на возможность побочных эффектов и токсичность препаратов.
Для профилактики осложнений аллергического характера тщательно собирать аллергологический анамнез.
При длительных курсах антибиотиков назначать противогрибковые препараты для профилактики дисбактериоза, а также витамины.
Использовать оптимальный путь введения. Существует поверхностная (промывание ран), внутриполостная (введение в грудную, брюшную полости, полость сустава) и глубокая (внутримышечное, внутривенное, внутриартериальное и эндолимфатическое введение) антибиотикотерапия, а также пероральный способ.
Современные принципы антибиотикотерапии
В последние годы классические принципы рациональной антибиотикотерапии существенно дополнены. Появилось понятие так- тика (или алгоритм) антибактериальной терапии хирургических инфекций. В основном это касается так называемой эмпирической терапии, то есть назначения антибиотиков, когда ещё не высеян штамм микроорганизмов и не определена его чувствительность к антибиотикам.
При эмпирической терапии соблюдают два принципа:
Принцип максимального спектра;
Принцип разумной достаточности.
Принцип максимального спектра подразумевает назначение антибиотиков максимального спектра действия и наибольшей эффектив- ности для обеспечения наибольшей вероятности уничтожения возбудителя заболевания. В то же время при этом высока вероятность формирования резистентных штаммов микроорганизмов и неэффективности применения в последующем курсов других антибиотиков.
Принцип разумной достаточности подразумевает назначение препарата не самого широкого спектра действия, но достаточно эффективного в отношении предполагаемого возбудителя. Вероятность до- стижения клинического эффекта весьма высока, и в то же время менее вероятно развитие резистентности, а в резерве остаются более мощные современные препараты.
Выбор подхода и сочетание двух этих принципов индивидуальны и зависят от степени тяжести инфекции, состояния пациента, виру- лентности микроорганизма. Весьма важно учитывать и экономическую сторону вопроса (на антибиотики приходится примерно 50% бюджета хирургического отделения).
Если у больного тяжёлое инфекционное заболевание, при эмпирической терапии целесообразно назначать либо комбинацию антибиотиков первой очереди (например, полусинтетический пенициллин ампициллин и аминогликозид гентамицин), либо проводить монотерапию антибиотиком второй очереди (обычно это цефалоспорины II и III поколений, реже - современные макролиды). Лишь при особо тяжёлой инфекции и неэффективности других препаратов используют антибиотики резерва - фторхинолоны и карбапенемы. При эмпирической терапии необходимо учитывать местные (региональные) особенности частоты распространения микроорганизмов и их резистентности. Важный фактор - развилась инфекция в стационаре (нозокомиальная инфекция) или вне его.
При этиотропной терапии выбор препарата зависит от результата микробиологического исследования (выделение возбудителя и определение его чувствительности к антибиотикам).
В современной хирургии доказана высокая эффективность так называемой ступенчатой терапии - раннего перехода с парентерального введения антибиотиков на пероральные формы препаратов той же группы или близких по спектру действия.
Антибиотикопрофилактика
Ещё недавно само существование такого термина было невозможным, так как одним из принципов антибиотикотерапии была недо- пустимость применения антибиотиков в профилактических целях. Однако сейчас этот вопрос пересмотрен. Более того, в последнее время антибиотикопрофилактике придают особое значение.
Для профилактики послеоперационных осложнений наиболее важно создать бактерицидную концентрацию препарата в плазме крови и зоне операции на момент выполнения разреза и в течение 1-2-х суток после вмешательства (в зависимости от вида операции по степени инфицированности). Поэтому антибиотики вводят с премедикацией или при вводном наркозе и продолжают вводить в течение 1-2 сут послеоперационного периода. Такие короткие курсы высокоэффективны и экономически выгодны. Препаратами выбора для антибиотикопрофилактики служат цефалоспорины II и III поколений, амоксициллин + клавулановая кислота.
ТЮМЕНСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
КАФЕДРА ОБЩЕЙ ХИРУРГИИ
АСЕПТИКА И АНТИСЕПТИКА
(Методическая разработка для студентов)
Тюмень - 2007 г.
Методическая разработка составлена сотрудниками кафедры общей хирургии Тюменской государственной медицинской академии доц. Горбачевым В.Н., асс. Черновым И.А., д.м.н. Цирятьевой С.Б.
Утверждена ЦКМС Тюменской государственной медицинской академии в качестве учебного пособия для подготовки к практическим занятиям по курсу общей хирургии для студентов III курса лечебного и педиатрического факультетов.
Рецензент: зав. кафедры общей хирургии, профессор А.И.Кечеруков.
АСЕПТИКА
Асептика - это метод хирургической работы, предупреждающий попадание микробов в рану путем уничтожения их на всех предметах, которые будут с ней соприкасаться. Основной закон асептики - «все, что приходит в соприкосновение с раной должно быть свободно от бактерий, т. е. стерильно».
В 1885 году русский хирург М.С. Субботин впервые оборудовал специальную операционную, в которой производил стерилизацию перевязочного материала, чем по существу и положил начало новому методу, названному асептикой.
В последующие годы Э.Бергман детально разработал и предложил метод асептики. Используя открытия Л. Пастера, совместно со своим учеником Шиммельбушем он обосновал методику уничтожения микробов на всем, что соприкасается с операционной раной. В связи этим Э. Бергман считается основателем асептики.
В это же время Т. Бильрот ввел форму для врачей хирургических отделений в виде белого халата и шапочки.
Для обеспечения асептической работы необходимо хорошо знать возможные источники попадания микробов в рану. Это два источника: экзогенный и эндогенный.
Экзогенной считается инфекция, попадающая в рану из внешней среды:
· из воздуха: пыль, капли жидкости (воздушно-капельная ) ;
· с предметами, соприкасающимися с раной: инструментарий, белье, перевязочный материал, руки хирурга (контактная) ;
· с предметами, оставляемыми в ране: шовный материал, дренажи, протезы и т.д.(имплантационная) .
Эндогенной считается инфекция, находящаяся внутри организма или на его покровах (кожа, дыхательные пути, желудочно-кишечный тракт и пр.). Эта инфекция может попасть в рану путем непосредственного занесения, либо по лимфатическим или кровеносным сосудам. Для профилактики эндогенной инфекции необходимо своевременное ее выявление и последующая санация (лечение тонзиллитов, синуситов, пиодермии и т.д.).
ПРОФИЛАКТИКА ВОЗДУШНО-КАПЕЛЬНОЙ ИНФЕКЦИИ
Для предупреждения воздушно-капельной инфекции применяется комплекс мер, главными из которых являются организационные мероприятия, направленные на уменьшение загрязнения воздуха микробами, а также на уничтожение уже имеющихся.
Принцип соблюдения правил асептики и антисептики лежит основе организации хирургического стационара. Большинство больниц строится в зеленых, наиболее чистых районах. Хирургические отделения не должны располагаться на первом этаже стационара, по возможности палаты должны быть рассчитаны на 1-2 человек. Площадь палат общехирургического профиля определяется из расчета 6,5 - 7,5 м 2 на одну койку при высоте помещения не менее 3 м и ширине не менее 2,2 м. Ориентация окон палат и лечебно-диагностических кабинетов хирургического отделения может быть любая, соотношение площади окон и пола составляет 1:6, 1:7. Температура воздуха в палатах должна составлять 18-20 0 С, влажность воздуха - 50-60%.
В хирургическом отделении должны быть оборудованы палаты для больных, пост палатной медсестры, процедурный кабинет, чистая и гнойная перевязочные, санитарная комната, лечебные и диагностические кабинеты, кабинеты заведующего отделением и старшей медсестры, ординаторская, сестринская.
Хирургическое отделение должно быть приспособлено для тщательной многократной влажной уборки с применением антисептических средств. Для этого полы должны быть каменными или заливными, либо покрыты линолеумом. Стены выложены плиткой или окрашены краской. В операционной и перевязочной эти же требования предъявляются и к потолкам. Мебель должная быть легкой, без сложной конфигурации поверхностей, иметь колесики для передвижения. Количество мебели следует максимально ограничивать в соответствии с потребностями.
Влажная уборка помещений производится ежедневно утром и вечером. Стены моют и протирают влажной тряпкой один раз в 3 дня. Один раз в месяц очищают от пыли и протирают от пыли верхние части стен, потолки, плафоны, протирают оконные и дверные рамы.
В хирургическом отделении обязательно использование спецодежды. Все работники должны иметь сменную обувь, халаты или специальные костюмы из легкой ткани, регулярно проходящие стирку. Оптимальным является использование санпропускника: сотрудники, приходящие на работу, принимают душ, снимают с себя повседневную одежду и надевают костюмы (халаты). Выход в спецодежде за пределы отделения не разрешается.
В перевязочной, процедурном кабинете, в операционной, в послеоперационных отделениях и отделении реанимации необходимо ношение колпаков и масок. Ношение колпаков обязательно для постовых медсестер, выполняющих различные процедуры у постели больно (инъекции, забор крови на анализ и т.д.).
Для профилактики воздушно-капельной инфекции большое значение имеет контроль за соблюдением правил личной гигиены медперсоналом, отстранение от работы сотрудников с простудными и гнойничковыми заболеваниями.
Согласно приказу № 720 1 раз в 3 месяца проводится обследование медперсонала на носительство стафилококка в носоглотке. При положительном ответе сотрудник отстраняется от работы, в течение 3-4 дней закапывает в нос антисептик, регулярно проводит полоскания зева, после чего у него повторно берут мазок из носоглотки.
Операционный блок удаляют от хирургических отделений. Лучше размещать его в изолированном помещении, соединенном с отделением переходом и связанном с отделением реанимации и интенсивной терапии. Указанный блок размещают с ориентацией окон на север или северо-запад. Для предотвращения загрязненности воздуха в непосредственной близости от операционной раны при организации операционного блока соблюдают принцип зональности. Существуют четыре зоны стерильности в операционной:
1. стерильная зона (операционная, стерилизационная).
2. зона строгого режима (предоперационная, наркозная, аппаратная).
3. зона ограниченного режима (инструментально - материальная, лаборатория срочных анализов, комната медицинских сестер, хирургов, протокольная).
4. зона общебольничного режима .
Основным принципом в работе оперблока является строжайшее соблюдение правил асептики. В связи с этим выделяют различные виды операционных: гнойные и чистые, плановые и экстренные. При составлении расписания операций в каждой операционной их порядок определяют в соответствии со степенью инфицированности – от менее инфицированной к более инфицированной.
Лица, участвующие в операции должны проходить строго регламентированную санитарно-гигиеническую подготовку: переодевание в зоне санпропускника, по возможности принятие душа. Операционную бригаду желательно обеспечить специальной бактерицидной одеждой из хлопчатобумажного материала, непроницаемого для жидкостей и бактерий.
Переодевание персонала в специальную операционную одежду (брюки, рубашка, бахилы) для работы в операционной или ее помещениях также преследует цель уменьшения опасности воздушной инфекции. По этой же причине недопустимо посещение операционных в шерстяных вещах. Необходимость нахождения в операционной в маске диктуется опасностью капельной инфекции. По этой же причине не разрешается разговаривать без крайней необходимости. Ноги должны быть обуты в бахилы. Хирург и ассистенты надевают фартуки, которые защищают одежду от загрязнения кровью, а также стерильный халат от инфицирования потом хирургов.
Перед входом в операционный блок обязательным является соблюдение "Правила красной черты" , т.е. все входящие за красную полосу должны надеть халат, шапочку, маску и бахилы.
Бактериологические исследования свидетельствуют о том, что в окружающую среду из дыхательных путей и кожных покровов в течение 1 минуты выделяется от 10 тыс. до 100 тыс. микробов, а при разговоре – до 1 млн. Поэтому, в операционной не должно быть лишних людей. После операции количество микробов в 1 м 3 воздуха возрастает в 3-5 раз, а при присутствии группу студентов из 5-6 человек – в 20-30. В связи с этим в операционной запрещается ведение лишни разговоров, а для просмотра операций устраиваются специальные колпаки либо используется система видеотехники.
В операционной и перевязочной температура воздуха должна быть не более 24 гр. С, влажность 50%.
Виды уборки операционной :
1. Предварительная - проводится ежедневно утром перед началом операций. Протирают антисептиками пол, стены, подоконники и др., чтобы убрать пыль, которая осела за ночь.
2. Текущая - в процессе операции убирают упавшие на пол предметы, вытирают пол, загрязненный кровью и другими жидкостями. По окончании операции обрабатывают операционный стол, пол вокруг стола и испачканную мебель.
3. Заключительная - после окончания операционного дня. Это мытье пола, стен (на высоту человеческого роста), протирают мебель.
4. Генеральная - мытье операционной один раз в 7 - 10 дней горячей водой с мылом и антисептиками, включая потолок. Протирают мебель и аппаратуру.
Уборка операционных осуществляется влажным способом (1% хлорамин Б, 3% перекись водорода с 0,5% раствором моющих средств, 0,2% дезоксон - 1, 2% дихлор - 1 и др.).
Для профилактики воздушно-капельной инфекции в операционной и перевязочной применяются бактерицидные ультрафиолетовые лампы. После 2 - 3 часовой работы бактерицидных ламп отмечается снижение микробного обсеменения по сравнению с исходным на 50 - 80 %. Бактерицидная лампа создает вокруг себя стерильную дозу до 2 - 3 метров.
Вентиляция операционных осуществляется через установки кондиционирования воздуха, фильтры, которые улавливают микроорганизмы. Очищенный воздух подается под небольшим давлением. Обмен воздуха осуществляется 7 - 10 раз в час. Вентиляция должна быть приточной (объем притока воздуха должен превосходить объем оттока).
С целью уменьшения загрязнения воздуха в операционной при особо чистых операциях (трансплантация органов и тканей) оперирующие хирурги и операционные сестры надевают специальные костюмы и шлемы, под которые поступает свежий воздух, подводимый в области лба. Выдыхаемый воздух и испарения кожи удаляют с помощью вакуумных отсосов за пределы операционной. В шлеме вмонтированы устройства системы связи между членами бригады.
Данная экипировка является обязательной для сверхчистых операционных с ламинарным течением воздуха. Через потолок операционной постоянно нагнетается стерильный воздух, прошедший через бактериальный фильтр. В пол вмонтировано устройство, забирающее воздух. Благодаря этому создается постоянное ламинарное (прямолинейное) движение воздуха, препятствующее вихревым потокам, поднимающим пыль и микроорганизмы с нестерильных поверхностей. Смена стерильного воздуха осуществляется до 500 раз в течение 1 часа, что приводит к снижению бактериальной обсемененности в десятки раз по сравнению с обычными операционными.
К недостаткам сверхчистых операционных относятся значительные экономические затраты на их содержание, необходимость постоянной технической и гигиенической проверки. В ином случае они могут стать источником бактериального обсеменения воздуха операционной ("бактериальная катапульта").
ПРОФИЛАКТИКА КОНТАКТНОЙ ИНФЕКЦИИ
Профилактика контактной инфекции сводится к осуществлению главного принципа асептики: «Все, что соприкасается с раной, должно быть стерильно».
С операционной раной соприкасаются: хирургический инструментарий, перевязочный материал и хирургическое белье, руки хирурга.
Основой для профилактики контактной инфекции является стерилизация – полное освобождение какого-либо предмета от микроорганизмов путем воздействия на него с помощью физических или химических факторов.
Используемые в практике методы стерилизации должны:
· обладать бактерицидной и спороцидной активностью;
· быть безопасными для больных и медперсонала;
· не должны ухудшать рабочие свойства инструментов.
В современной асептике используют физические и химические методы стерилизации .
Физические методы стерилизации
Обжигание и кипячение
Обжигание в хирургической практике для стерилизации инструментов не используется.
Все меньше применяется в настоящее время и стерилизация инструментов с помощью кипячения, так как при этом методе достигается температура лишь в 100 0 С, что недостаточно для уничтожения спороносных бактерий.
Стерилизация паром под давлением (автоклавирование)
Впервые стерилизация паром под повышенным давлением в автоклаве осуществлена в 1884 году Л.Л. Гендейрейхом.
При этом способе стерилизации действующим агентом является горячий пар. В автоклаве возможно нагревание воды под повышенным давлением, что приводит к повышению точки кипения воды и соответственно пара до 132,9 0 С (при давлении 2 атм.). При стерилизации высокой температурой различают следующие рабочие фазы:
1. Время нагревания (время от начала нагрева до достижения предписанной температуры в рабочей камере).
2. Время уравновешивания (от момента достижения температуры стерилизации в рабочей камере до момента выравнивания ее во всем стерилизуемом материале).
3. Время уничтожения (время, необходимое для уничтожения микробов, предписанное инструкцией).
Надежность стерилизации достигается путем увеличения времени уничтожения на 50 %. Истинное время стерилизации в полезном пространстве состоит из времени уравновешивания, времени дополнительного уничтожения и времени дополнительной безопасности. Прерывание стерилизации в одну из фаз или не достижение необходимых температурных параметров требует повторной стерилизации (режим стерилизации регламентирован приказом МЗ N 720 от 31. 07. 78.).
Метод автоклавирования применяется для стерилизации хирургического инструментария, перевязочных материалов, белья, перчаток, которые погружаются в специальные металлические биксы Шиммельбуша.
Работа автоклава контролируется показаниями манометра и термометра.
Основные режимы стерилизации:
При давлении 1,1 атм. (t – 119,6 0 C) – 45 мин – стерилизация перчаток.
При давлении 2 атм. (t – 132,9 0 C) – 20 мин – стерилизация перевязочного материала, белья, хирургического инструментария.
Закрытый бикс сохраняет стерильность находящихся в нем предметов 72 часа.
Сухожаровая стерилизация
Действующим агентом при этом способе является нагретый воздух. Стерилизация осуществляется в специальных аппаратах – шкафах-стерилизаторах.
Следует отметить, что горячий воздух в отличие от водяного пара служит только переносчиком тепла. В связи с этим температура стерилизации повышается и должна быть 160 - 200 0 С. При температуре 180 0 С время стерилизации составляет 60 минут. При определении времени стерилизации необходимо принимать во внимание время уравновешивания, которое продолжительнее, чем при стерилизации паром.
Стерилизация в сухожаровом шкафу является главным и наиболее надежным способом стерилизации хирургических инструментов.
Лучевая стерилизация .
Используют гамма и бета - частицы и относительно тяжелые нейтроны, протоны и т. д. Разница вызываемых ими биологических изменений почти незаметна. Радиоактивное излучение, проходя через среду, вызывает ионизацию последней, в связи с чем его называют ионизирующим излучением. Бактерицидный эффект ионизирующего излучения обусловлен воздействием на метаболические процессы бактериальной клетки. Наибольшее применение получила стерилизация гамма-лучами. Используются изотопы Co 60 иCs 138 . Доза проникающей радиации значительна и составляет 2-2,5 Мрад. В связи с этим лучевая стерилизация в стационарах не производится и применяется в промышленных условиях.
Метод применяется для стерилизации одноразовых инструментов (шприцы, шовный материал, катетеры, зонды, системы для переливания крови, перчатки и др.). При сохранении целостности упаковки стерильные свойства предметов сохраняются в течение 5 лет.
Ультразвуковая стерилизация
Механические колебания с частотой от 2х10 4 до 2х10 8 колебаний в 1 секунду не воспринимаются ухом человека и называются ультразвуком. Для искусственного получения ультразвука служат специальные приборы. Источником ультразвука являются кристаллы кварца, турмалина, обладающие пьезоэлектрическими свойствами. Пьезоэлектрический эффект обусловлен явлением электрической поляризации кристаллов.
При воздействии на ткани ультразвуковой волны происходит образование микроскопических полостей, которые быстро закрываются под воздействием последующего сжатия. Такое явление называется кавитацией. Ультразвуковая кавитация приводит к образованию свободных радикалов, диссоциации молекул воды на ионы Н + и ОН - , что приводит к нарушению окислительно-восстановительных процессов в микробной клетке.
Ультразвуковые волны используются для стерилизации инструментов, подготовки рук медицинского персонала к операции. Для этого руки (инструменты) погружают в специальную ванну с дезинфицирующим раствором, через который пропускают ультразвуковые волны.
Стерилизация инфракрасными лучами
Применяется в инфракрасных и конвейерных печах с глубоким вакуумом для скоростной стерилизации хирургического инструментария.
Инфракрасная печь представляет собой двухстороннюю автоматизированную камеру, снабженную 8 инфракрасными нагревателями и вакуумным насосом. Сначала в камере создается разряжение 1 - 2 мм. рт. ст., а затем производится нагревание до 280 гр. С. в течение 7 минут. По окончании стерилизации вместо воздуха в камеру впускают азот. Это приводит к быстрому охлаждению и предотвращает окисление инструментов.
Конвейерная печь, изготовляемая в Англии, работает при t -180 0 С. Стерилизация осуществляется в течение 7,5 минут.
Химические методы стерилизации
К химическим методам относят газовую стерилизацию и стерилизацию растворами антисептиков.
Газовая стерилизация.
Газовая стерилизация осуществляется в специальных герметичных камерах. Стерилизующими агентами обычно являются пары формалина (на дно камеры кладут таблетки формальдегида) или окись этилена. Стерильность инструментария достигается за счет алкилирования протеинов бактерий через 6-48 часов (в зависимости от компонентов газовой смеси и температуры в камере).
Рабочей концентрацией окиси этилена является 555мг/л. В связи с тем, что окись этилена взрывоопасна, ее чаще всего используют в смеси с инертными газами (10% окиси этилена и 90% углекислоты). Эта смесь в литературе обозначается как карбокс или карбоксид. Активность окиси этилена возрастает при повышении температуры (в 2,74 раза на каждые 10 0 С повышения температуры).
Отличительной особенностью метода является минимальное отрицательное влияние на качество инструментария, в связи с чем его используют для стерилизации оптических, особо точных и дорогостоящих инструментов. Метод применятся непосредственно в стационарах.
Стерилизация растворами антисептиков
В основном используется для стерилизации режущих хирургических инструментов.
Для стерилизации используются: тройной раствор А, 96% этиловый спирт и 6% р-р перекиси водорода, спиртовой р-р хлоргексидина, первомур.
Для «холодной» стерилизации инструменты погружают в разобранном или в раскрытом виде в один из этих растворов. При замачивании в спирте и тройном растворе А инструменты становятся стерильными через 2-3 часа, в перекиси водорода – через 6 часов.
СТЕРИЛИЗАЦИЯ ХИРУРГИЧЕСКИХ ИНСТРУМЕНТОВ
Предстерилизационная подготовка хирургических инструментов, бывших в употреблении, осуществляется следующим образом:
1. Бывшие в употреблении, но не инфицированные инструменты моют проточной водой щетками в течение 5 минут, затем замачивают в растворе А (пергидроль - 20,0, ПАВ "Астра" - 5,0; вода - 975 мл.) при 50 0 С – на 15-20 минут.
2. Инструменты, загрязненные гноем или кишечным содержимым, помещают в 5% раствор лизола на 30 минут.
3. Инструменты и шприцы после операции у больного с анаэробной инфекцией замачивают в 6 % растворе перекиси водорода + 0,5 % раствор ПАВ "Астра" на 1 час, затем кипятят 90 минут.
В настоящее время с целью профилактики ВИЧ-инфекции все инструменты после использования перед прохождением обычной предстерилизационной подготовки должны быть замочены в 3% р-ре хлорамина в течение 60 минут или в 6% р-ре перекиси водорода в течение 90 минут (приказ № 86 от 30.08.89 МЗ СССР).
Стерилизация нережущих металлических инструментов осуществляется с помощью:
1. Стерилизации в сухожаровом шкафу при t - 180-200 0 C в течение 60 минут.
2. Автоклавирования при давлении в 2 Атм (132,9 град. С.) в течение 20 минут.
3. Кипячения в дистиллированной воде с добавлением натрия гидрокарбоната (20 гр. на 1 литр воды) – 45 минут.
Инструменты после операций по поводу анаэробной инфекции и в группе риска по гепатиту или ВИЧ-инфекции кипятить нельзя.
Режущие и колющие инструменты кипятят в течение 3-х минут без добавления гидрокарбоната натрия, затем погружают в 96 % этанол на 2 - 3 часа.
Кипячение шприцов осуществляется в разобранном виде в бидистиллированной воде в течение 45 минут. Стеклянная часть шприца при этом обертывается марлей.
Согласно приказу МЗ N 720 от 31.07.78 инструментарий, используемый во время операции, рекомендуется стерилизовать в сухожаровых шкафах при температуре 180 0 С в течение 1 часа. В таких же условиях должны стерилизоваться и режущие инструменты, что приводит к некоторому снижению их остроты, но обеспечивает абсолютную стерильность.
Эти изменения в организации стерилизации связаны с частой высеваемостью патогенной флоры после вышеописанных традиционных способов стерилизации.
Одноразовые инструменты (пинцеты, зажимы, зонды, скальпели) стерилизуются с помощью ионизирующего излучения в заводских условиях.
СТЕРИЛИЗАЦИЯ ОПТИЧЕСКИХ ПРИБОРОВ
Основным методом стерилизации оптических инструментов, требующих наиболее щадящей обработки с исключением нагревания, является газовая стерилизация. Этим способом обрабатываются все инструменты для лапароскопических и торакоскопических вмешательств, что связано с их сложным устройством и дороговизной.
Для этого используется:
· стерилизация окисью этилена при концентрации газа 555 мг/л в течение 16-16 часов;
· стерилизация в формалиновой камере, на дно которой кладут таблетки формальдегида, в течение 48 часов.
При стерилизации фиброгастроскопов, холедохоскопов, колоноскопов применяется замачивание в 2% р-ре глютарового альдегида (активатор) и гипохлорида натрия (ингибитор коррозии) в течение 45-180 минут.
СТЕРИЛИЗАЦИЯ ПЕРЕВЯЗОЧНОГО МАТЕРИАЛА И БЕЛЬЯ
Перевязочный материал и белье стерилизуют в автоклаве при давлении 2 атм. (132,9 0 С.) в течение 20 минут.
Белье и материал стерилизуются в биксах или матерчатых двухслойных мешках.
Существуют 3 вида укладки бикса:
1. Универсальная - в бикс или матерчатый комплект закладывают разный материал: шарики, салфетки, вату, халаты, тампоны и т. п. В этих случаях бикс делят на секторы, в каждом из которых находится тот или иной материал. Такая укладка применяется в хирургических отделениях с небольшим объемом работы.
2. Специализированная - в каждый из биксов укладывают один вид материала (халаты, салфетки и т.п.). Применяется в хирургических отделениях с большим объемом работы.
3. Целенаправленная - в бикс укладывается материал, который может потребоваться для определенного оперативного вмешательства.
Допустимый срок сохранения материала после стерилизации в биксах - 3 суток; в мешках - 24 часа.
СТЕРИЛИЗАЦИЯ ПЕРЧАТОК
Предстерилизационная подготовка: перчатки моют проточной водой, а затем замачивают в растворе А (пергидроль - 20,0; ПАВ "Астра" - 5,0; вода - 975 мл.).
В настоящее время применяются следующие способы стерилизации перчаток:
1. Лучевая стерилизация – применяется в промышленных условиях. Основной метод стерилизации одноразовых перчаток.
2. Автоклавирование при давлении 1,1 атм. в течение 45 минут - при многократном использовании перчаток.
3. Кипячение в воде (без добавления соды) в течение 15 минут. Следует отметить, что этот способ применяется редко. Резиновые изделия быстро портятся.
4. Холодная стерилизация в 6 % растворе перекиси водорода, 0,5 % растворе детергента в течение 3-х часов при температуре 50 0 С.
5. Химическая стерилизация в автоматических газовых стерилизаторах при концентрации окиси этилена 555 мг./л в течение 4-х часов.
В экстренных случаях для стерилизации перчаток используется обработка в течение 5 минут тампоном, смоченным 96 % спиртом.
Для поддержания стерильности по ходу операции перчатки обрабатывают 2.4 % первомуром и протирают 96 % этанолом.
ОБРАБОТКА РУК ХИРУРГА
Одним из важнейших мероприятий по профилактике контактной инфекции является обработка (мытье) рук хирурга.
Предложено много методов для подготовки рук к операции. Все они могут быть разделены на две группы. В основу одной из них положена механическая очистка и дезинфекция, в основу других - только дубление кожи рук. Последние способы представляют исторический интерес и в настоящее время не применяются.
Основными способами обработки рук хирурга являются:
Метод Спасокукоцкого - Кочергина основан на растворении щелочным раствором аммиака жиров на поверхности и в порах кожи и вымывании вместе с ними бактерий. Предварительное мытье рук с мылом и щеткой не имеет достаточных оснований. Мыло в соединении с нашатырным спиртом образует нерастворимые калийные соли, которые закрывают поры кожи и препятствуют действию нашатырного спирта.
I этап - обычное обмывание рук с мылом в течение 1 минуты.
II этап - свежеприготовленный 0,5 % раствор нашатырного спирта наливают в два предварительно обожженных спиртом эмалированных тазика. Руки тщательно моют марлевой стерильной салфеткой или губкой в каждом тазике по 3 минуты, в первом тазике до локтя, во втором - только кисти и нижнюю часть предплечья.
III этап - осушивание рук стерильным полотенцем или салфеткой сначала кистей, потом предплечья;
IV этап - обработка рук 96 % этиловым спиртом (этанолом) в течение 5 минут, а затем ногтевых лож 5 % спиртовой настойкой йода.
Обработка рук дегмином и дегмицидом. Эти антисептики относятся к четвертичным аммониевым соединениям. Раствор антисептика заливают в емкость, в которую помещают стерильные губки. Руки обрабатывают 2 –мя губками по 3 минуты каждой, после чего высушивают стерильной марлевой салфеткой. Обработка рук 96 % этиловым спиртом или спиртовой настойкой йода не производится в связи с возможным дерматитом.
Обработка рук первомуром (раствором С-4).
Раствор С-4 готовят следующим образом: отмеренное количество перекиси водорода 33% (171 мл.) и 85% муравьиной кислоты (81 мл.) сливают в стеклянную колбу (вначале вливают перекись водорода, а затем муравьиную кислоту), встряхивают и ставят в холодильник на 90 минут. Это время необходимо для образования антисептического реагента - надмуравьиной кислоты, вызывающей образование тончайшей пленки на поверхности кожи, закрывающей поры и исключающей необходимость дубления. После этого содержимое рабочей смеси разводят дистиллированной водой - 10 литров. Раствор используется для обработки рук, а также операционного поля и может применяться в течение 1 суток (позднее обеззараживающий эффект теряется).
Раствор наливают в тазик, обеззараженный путем обжигания или протирания первомуром эмалированный. Руки предварительно моют с мылом в проточной воде 1 минуту (без щеток), осушивают полотенцем, а затем моют в растворе первомура в течение 1 минуты: 30 сек. до локтя и затем 30 сек. только кисти, после чего осушивают стерильной салфеткой в той же последовательности, как по методу Спасокукоцкого - Кочергина. Обработка 96 % этанолом и йодом не рекомендуется из-за возможного раздражения кожи рук. В одном тазике, не меняя раствора, могут вымыть руки 10 - 11 человек.
Недостатком метода является возможность развития дерматита на коже рук хирурга.
Обработка рук хлоргексидином биглюконатом (гибитаном). Используется 0,5% спиртовый раствор хлоргексидина. После предварительного мытья рук в проточной воде с мылом руки обрабатывают в тазике с 0,5% спиртовым раствором хлоргексидина в течение 3 минут. После осушивания стерильной салфеткой одевают резиновые перчатки.
Обработка АХД, АХД-специаль, евросептом . Препараты находятся в специальных флаконах, из которых при нажатии на определенный рычаг определенная доза антисептика выливается на руки хирурга, после чего производится обработка рук в течение 2-3 минут. Процедура выполняется дважды. Дополнительное высушивание и дубление не требуются.
Обработка рук церигелем. Церигель – пленкообразующий антисептик из группы детергентов. Методика: в течение 2-3-х минут церигель наносится на поверхность рук, при этом образуется пленка. Метод применяется в экстренных ситуациях, при выполнении кратковременных вмешательств и не требует одевания стерильных перчаток. В настоящее время применяется редко.
Обработка рук хирурга ультразвуком. Для быстрой обработки рук в последние годы сконструированы специальные аппараты с ультразвуковыми ваннами, в которых мытье и дезинфекция рук происходят в течение 1 минуты. Мытье осуществляется погружением рук в 0,05% водный раствор хлоргексидина, через который пропускают ультразвуковые волны, обеспечивающие" эффект мытья".
Обработка рук методом Бруна заключается в обработке 96 % этанолом в течение 10 минут. В настоящее время применяется редко.
Обработка рук растворами моющих средств ОП-7, "Новость", "Астра " используется при невозможности обработки рук с помощью других способов. Одну столовую ложку моющего средства растворяют в 3-х литрах теплой воды в эмалированном тазике, в котором моют руки в течение 3-х минут. После высушивания стерильной салфеткой руки протирают 96 % этанолом 3 минуты и надевают стерильные резиновые перчатки.
ОБРАБОТКА ОПЕРАЦИОННОГО ПОЛЯ
На операционном столе операционное поле обрабатывается растворами химических антисептиков (йодонат, йодпирон, хлоргексидин, первомур, 70% спирт, АХД, стерильные клеящие пленки). При этом соблюдаются следующие правила:
1. Широкая обработка;
2. Последовательность «от центра к периферии»;
3. Загрязненные участки обрабатывают в последнюю очередь
4. Многократность обработки во время операции (правило Гроссиха-Филончикова ): обработка кожи производится перед ограничением стерильным бельем, непосредственно перед разрезом, периодически в ходе операции, а также перед наложением швов на кожу и после него.
ИМПЛАНТАЦИОННАЯ ИНФЕКЦИЯ
Имплантация – внедрение, вживление в организм больного искусственных чужеродных материалов и приспособлений с определенной лечебной целью. Источниками имплантационной инфекции являются:
· Шовный материал;
· Дренажные трубки;
· Катетеры;
· Протезы клапанов сердца, сосудов, суставов и т.д.;
· Специальные металлические приспособления (скобки и скрепки из сшивающих аппаратов, спицы, шурупы, плстины для остеосинтеза);
· Кава-фильтры, спирали, стенты;
· Трансплантированные органы.
Основным вероятным источником имплантационной инфекции является шовный материал, постоянно используемый хирургами.
Классификация шовного материала:
1. По происхождению:
а) естественного происхождения: шелк, кетгут (изготавливается из подслизистого слоя кишечника крупного рогатого скота);
б) искусственного (синтетического) происхождения: капрон, лавсан, дексон, викрил, полипропилен, ПДС и др. виды шовного материала.
2. По способности к биодеструкции.
А) рассасывающиеся:
· кетгут;
· коллаген;
· материалы на основе целлюлозы: окцелон, кацелон;
· на основе полигликолидов: полисорб, викрил, дексон, максон;
· полидиоксанон: ПДС, ПДС –2;
· монокрил;
· капроаг;
· полиуретан.
Б) медленно рассасывающиеся:
· полиамидные (капроновые) нити: капрон, этилон, нуролон, дермалон, монософ.
В) нерассасывающиеся:
· полиэфиры: лавсан, суржидак, мерсилен, этибонд;
· полиолефины; суржипро, пролен, полипропилен, суржилен;
· фторполимеры: флексамид;
· поливинилиден;
· металлическая проволока;
· нитинол.
Рассасывающиеся нити используются для сшивания быстро срастающихся тканей: мышц, подкожно-жировой клетчатки, при операциях на органах желудочно-кишечного тракта, желчных и мочевыводящих путях.
Медленно рассасывающиеся, нерассасывающиеся нити применяются для наложения швов на коду, подкожно-жировую клетчатку, ушивании разрезов грудной и брюшной стенки.
3. По структуре нити:
· Мононить (монофиламентная) в сечении представляет единую структуру с абсолютно гладкой поверхностью.
· Полинить (многофиламентная) в сечении состоит из множества нитей:
- крученая нить изготавливается путем скручивания нитей по оси;
- плетеная нить получается путем плетения многих филамент по типу каната;
- комплексная нить – это плетеная нить, пропитанная или покрытая полимерными материалами.
Монофиламентные нити применяются в микрохирургии, в косметической хирургии, при операциях на сердце и сосудах, в желудочно-кишечной хирургии.
Способы стерилизации шовного материала
В настоящее время основным способом стерилизации шовного материала является лучевая стерилизация в заводских условиях. Шовный материал стерилизуется и в упаковке поступает в лечебные учреждения.
Классические методы стерилизации шелка (метод Кохера) и кетгута (метод Ситковского в парах йода, методы Губарева и Клаудиуса в спиртовом и водном растворах Люголя) в настоящее время практически оставлены из-за длительности, сложности и не достаточной эффективности.
В условиях стационара стерилизуются капрон, лавсан и металлические скрепки. Для их стерилизации используется кипячение в течение 15 минут в растворе С-4 (первомур); автоклавирование при давлении 2 атм. в течение 20 минут. После стерилизации шовный материал следует хранить в 96% спирте.
СПОСОБЫ КОНТРОЛЯ СТЕРИЛЬНОСТИ
Методы контроля стерильности делятся на прямые и непрямые .
Прямым методом контроля стерильности является бактериологическое исследование. Его недостаток – длительность проведения исследования, результаты становятся известными через 3-5 дней, в то время как использовать инструменты целесообразно сразу после стерилизации. В связи с этим метод применяется для выборочного контроля стерильности хирургических материалов в плановом порядке, и по его результатам судят о методических погрешностях в работе медперсонала или дефектах используемого оборудования.
Контроль обсемененности разных объектов и воздуха в хирургических отделениях производится 1 раз в месяц. Выборочный контроль стерильности инструментов, перевязочного материала, рук хирурга, кожи, операционного белья и др. проводят 1 раз в 7дней, шовного материала – 1 раз в 10 дней.
Непрямые методы контроля используются при термических способах стерилизации и позволяют определить температуру, при которой производилась стерилизация, не давая ответ на вопрос о присутствии или отсутствии микрофлоры.
Так при автоклавировании в бикс кладут ампулу с веществом, имеющим температуру плавления в пределах 110-120 0 С: бензойную кислоту, резорцин, антипирин . После стерилизации сестра обращает внимание на эту ампулу: если вещество расплавилось, то материал стерильный, если нет – нагревание было недостаточным и пользоваться таким материалом нельзя – он нестерильный. Вместо ампулы в бикс можно положить термоиндикаторные полоски или максимальный термометр, по которому определяют, достигалась ли во время стерилизации необходимая температура.
Для контроля стерилизации в сухожаровом шкафу используются вещества с более высокой точкой плавления (180-190 0 С): аскорбиновая кислота, янтарная кислота, тиомочевина.
Контроль качества предстерилизационной подготовки
Используются вещества, с помощью которых можно обнаружить на инструментах следы неотмытой крови или остатки моющих средств. Реактивы меняют свой цвет в присутствии соответствующих веществ.
Для обнаружения скрытой крови наиболее часто используется бензидиновая проба, для выявления следов моющих средств - фенолфталеиновая проба.
ЭНДОГЕННАЯ ИНФЕКЦИЯ
Эндогенной называется инфекция, источник которой находится в организме больного. Источники эндогенной инфекции:
· Кожные покровы больного;
· Желудочно-кишечный тракт;
· Ротовая полость;
· Очаги «дремлющей» инфекции: кариозные зубы, воспалительные заболевания мочевыводящих путей, хронический тонзиллит, хронический бронхит и т.д.
Пути попадания микроорганизмов в рану:
· по сосудам (гематогенный),
· по лимфатическим сосудам (лимфогенный);
· непосредственный (контактный)
Профилактика эндогенной инфекции включает выявление возможных очагов эндогенной инфекции перед выполнением операции. Обязательный минимум обследования перед плановой операцией включает:
· Общий анализ крови;
· Общий анализ мочи;
· Биохимический анализ крови;
· Флюорография грудной клетки;
· Анализ крови на RW;
· Кровь на антитела к ВИЧ;
· Заключение стоматолога о санации полости рта;
· Заключение гинеколога;
· Осмотр терапевта.
Если при обследовании выявлен источник эндогенной инфекции (кариес, аднексит и др.), плановую операцию нельзя выполнять до ликвидации воспалительного процесса. После перенесенного инфекционного заболевания запрещается выполнение плановой операции в течение 2-х недель после полного выздоровления
ВНУТРИБОЛЬНИЧНАЯ (ГОСПИТАЛЬНАЯ ИНФЕКЦИЯ)
Госпитальная инфекция – заболевания или осложнения, развитие которых связано с инфицированием больного во время нахождения его в хирургическом стационаре.
Госпитальную инфекцию называют также нозокомиальной (noso – болезнь, komos –приобретение), тем самым подчеркивается, что развитие заболевания или его осложнений связано с пребыванием в стационаре в результате проведения лечебно-диагностических мероприятий.
Явление возможного инфицирования пациента во время нахождения его в стационаре обозначается как «эффект госпитализации» .
Госпитальная инфекция вызывается устойчивыми к антибиотикам и основным антисептикам условно-патогенными микроорганизмами, наиболее часто стафилококками, клебсиелами, кишечной палочкой, энтребоактериями, синегнойной палочкой, Proteus vulgaris, вирусамиивозникает у ослабленных в результате заболевания или операции пациентов.
Процесс развития вирулентной, устойчивой к антибактериальным препаратам инфекцииназываетсясуперинфекцией.
Возбудители госпитальной инфекции имеют сродство к сырости и наиболее часто определяются в ванных комнатах, на умывальниках, мочеприемниках, полотенцах, тряпках, цветочных горшках.
Среди форм внутрибольничной инфекции чаще встречаются: инфекция мочевых путей (40%), раневая (25%), дыхательной системы (16%), септицемия (3-5%).
Пути распространения: контактно от больного к больному, от персонала и посетителей к больному и наоборот.
С увеличением длительности пребывания больного в стационаре опасность заражения возрастает.
В связи с этим мероприятия основные мероприятия по борьбе с госпитальной инфекцией включают в себя:
1. Сокращение предоперационного койко-дня;
2. Сокращение длительности послеоперационного периода, ранняя выписка пациентов с контролем на дому;
3. Разделение потоков больных, гнойных и чистых палат, отделений, операционных и оборудования;
4. Предупреждение перекрестного инфицирования: внедрение одноразового белья, полотенец, перчаток;
5. Дезинфекция рук персонала и врачей перед прямым контактом с больным и после него;
6. Дезинфекция матрацев, подушек, одеял и др.;
7. Рациональное назначение антибиотиков;
Следует отметить, что согласно приказу МЗ N 720 во всех стационарах создаются комиссии по борьбе с внутрибольничной инфекцией, которые собираются 1 раз в квартал и по мере необходимости при развитии госпитальной инфекции.
Для профилактики развития госпитальной инфекции все сотрудники стационара согласно приказу МЗ N 720 1 раз в квартал проходят исследование на носительство патогенного стафилококка.
Контроль обсемененности разных объектов и воздуха в хирургических отделениях осуществляется 1 раз в месяц. Выборочный контроль стерильности инструментов, перевязочного материала, рук хирурга, кожи, операционного белья и др. проводят 1 раз в неделю.
Следует отметить, что госпитальная инфекция остается важнейшей проблемой хирургии. Несмотря на разработку новых более мощных антибиотиков, частота гнойных осложнений в хирургии снизилась незначительно и продолжает оставаться высокой.
АНТИСЕПТИКА
ИСТОРИЧЕСКАЯ СПРАВКА
Н.И.Пирогов одним из первых высказал мысль, что заражение ран вызывается руками хирурга и его помощников, а также через белье и постельные принадлежности. Для предупреждения возможного заражения ран применял для дезинфекции спирт, ляпис, йод.
В 1847 г., основываясь на большом личном опыте, венгерский врач акушер - гинеколог И. Земельвейс предположил, что причина послеродового сепсиса - это занесение заразительного начала руками врача во время внутреннего исследования после родов. Введение им в практику мытья рук 10 % раствором хлорной извести значительно сократило количество указанных осложнений.
Английский хирург Д.Листер, основываясь на открытиях Л.Пастера и анализе причин гибели больных после операций, пришел к выводу, что причиной осложнений являются бактерии. Разработал ряд методик уничтожения микробов в воздухе, на руках, в ране, а также на предметах, соприкасающихся с раной. В качестве средства уничтожения микробов избрал карболовую кислоту. Разработал систему мероприятий, направленных на уничтожение микробов в ране, получивших наименование антисептического метода хирургической работы (1867 г.).
ПОНЯТИЕ И СУЩНОСТЬ АНТИСЕПТИКИ
Антисептика - это единый лечебно-профилактический комплекс мероприятий, направленных на уменьшение количества микробов в ране, снижение их жизнеспособности, опасности проникновения в окружающие ткани и другие среды организма, а также на снятие интоксикации, повышение иммунно-биологической активности больного организма и его реактивности.
Современная хирургическая антисептика неразрывно связана с асептикой и объединяется с ней в одну общую систему. В зависимости от принципа действия различают механическую, физическую, химическую, биологическую и смешанную антисептику.
МЕХАНИЧЕСКАЯ АНТИСЕПТИКА
Предусматривает применение механических приемов, удаляющих из раны некротизированные ткани, инородные тела, очищение раны от микробов и всего, что является питательной средой для них. С этой целью используется ряд приемов:
а) Туалет раны - выполняется путем удаления инструментами инородных тел, отторгшихся и свободно лежащих в ране или путем вымывания их стерильными антисептическими растворами физиологической концентрации. Применение современной аппаратуры и методов количественной бактериологии позволило использовать для промывания большие количества стерилизующих жидкостей. В последние годы для туалета раны производится ее обработка с помощью пульсирующей струи антисептика или изотонического раствора хлорида натрия. Рану обрабатывают струей жидкости с частотой пульсации 60 - 100 в минуту, при этом расходуется 600-700 мл. антисептика.
б) Первичная хирургическая обработка раны - производится не позднее 12 часов после ранения. Согласно современным взглядам, первичная хирургическая обработка раны производится не столько для "стерилизации ножом", сколько для уменьшения в ране нежизнеспособных тканей, являющихся благоприятной питательной средой для микрофлоры.
Техника операции состоит в рассечении раны, ее карманов и иссечения краев, стенки и дна раны в пределах здоровых тканей. Удаляют все поврежденные, загрязненные, пропитанные кровью ткани, инородные тела, сгустки крови, не повреждая крупные сосуды и нервы. Толщина слоя иссекаемых тканей составляет от 0,5 до 2 см. После иссечения меняют инструменты, перчатки и проводят перевязку мелких сосудов с последующим наложением швов на ткани и кожу.
в) Вторичная хирургическая обработка раны выполняется в случаях, когда раневой процесс осложнился инфекционным воспалением. Удаляются некротические ткани, выясняется, нет ли в ране углублений, карманов или затеков, из которых затруднено вытекание экссудата. При наличии затруднений для его свободного оттока, ход расширяется, что в последующем приводит к быстрому купированию гнойно-воспалительного процесса. Швы на рану не накладываются, операцию завершают дренированием гнойных полостей.
ФИЗИЧЕСКАЯ АНТИСЕПТИКА
Предусматривает применение физических методов, создающих в ране неблагоприятные условия для развития бактерий, всасывания токсинов и продуктов распада тканей.
Крайне важным элементом физической антисептики является дренирование . Дренажи используют для создания оттока из раны или полостей, для введения в них антибиотиков и других препаратов с антисептическим действием, для промывания полостей. Дренажи можно вводить в полости (брюшную, плевральную и др.), в просвет внутренних органов (желчный пузырь, кишка, мочевой пузырь и др.)
Этот метод применяется при лечении всех видов ран, после большинства операций на грудной и брюшной полости и основан на принципах капиллярности и сообщающихся сосудов. Различают три основных метода дренирования: активное, пассивное иосмотическоедренирование.
Активное дренирование (аспирация)
При активном дренировании в области наружного конца дренажа создается отрицательное давление. Для этого к дренажам присоединяется сжатая резиновая груша, электрический отсос, аппарат Боброва.
Разновидностью активного дренирования является аспирация содержимого с помощью трехбаночнойсистемыСубботина-Пертеса , в которой банки соединены последовательно резиновыми трубками. Первая банка предназначена для оттока содержимого из раны или полости. Вторая наполняется антисептической жидкостью и устанавливается выше уровня раны. Третья - пустая и устанавливается ниже. При перемещении жидкости из второй банки в третью во второй создается разряженное пространство, что обеспечивает присасывающее действие в первую банку.
В хирургической практике нередко применяют вакуумный дренаж по Редону . Метод заключается в следующем: нагретый до 100 0 С в воде бутыль закрывают герметично резиновой пробкой. По мере охлаждения в сосуде постепенно создается отрицательное давление до 75-100 мм.рт.ст. Подключение такой системы к дренажу обеспечивает удаление из воспалительного очага до 180 мл. экссудата.
С целью активного дренирования можно использовать дозированную вакуум-аспирацию аппаратом ОП-1 конструкции Л.Л. Лавриновича . Аппарат позволяет поддержать заданное разряжение от 10 до 120 мм. водного столба в течение практически неограниченного времени.
Перспективно применение дренирования раны двухпросветным дренажом по Н.Н. Каншину . Дренаж состоит из трубки диаметром 0,6-0,8 см., на одной из стенок которой расположен микроирригатор 1-1,5 мм. Канал большого диаметра служит для аспирации, микроирригатор для постоянного орошения раны. Аспирация осуществляется с помощью аспиратора, сконструированного на основе аквариумного виброкомпрессора ВК-1.
Необходимым условием для активного дренирования является герметичность раны, что обеспечивается путем наложения на нее на всем протяжении кожных швов.
Пассивное дренирование
Для указанного вида дренирования используют полоски перчаточной резины; так называемые «сигарообразные дренажи», когда внутрь резиновой перчатки вводится марлевый тампон, смоченный раствором антисептиком; резиновые и полихлорвиниловые трубки. При пассивном дренировании отток жидкости осуществляется по принципу сообщающихся сосудов, поэтому дренаж должен находиться в нижнем углу раны, а второй свободный его конец – ниже раны.
Недостатком пассивного дренирования является то, что через 8 часов марля, пропитавшись кровью и гноем, прекращает свое действие и может стать "пробкой", закупоривающей рану. Перевязывать больных 3 раза в сутки невозможно и не целесообразно. Поэтому, чтобы тампон не создавал препятствие для оттока раневого отделяемого, его нужно вводить в рану рыхло, чтобы спустя 8 часов отток раневого отделяемого мог осуществляться по каналу рядом с дренажем.
Для дренирования плевральной полости широко применяется устройство, предложенное Бюлау , где для движения жидкости из полости плевры используется механизм изменения объема плевральной полости и легких при дыхании. На наружный конец трубки, введенной в плевральную полость, надевается палец из резиновой перчатки и завязывается на ней. На конце резинового пальца путем надсечки создается клапан, и трубка с пальцем опускается в антисептическую жидкость. Такой клапан при выдохе позволяет гною вытекать из плевральной полости, а при вдохе препятствует поступление в нее наружного воздуха и жидкости из банки за счет слипания лоскута резинового пальца.
Осмодренирование
В целях более эффективного дренирования марли ее смачивают осмотически-активными средствами: 10% р-ром NaCl, 25% р-ром сульфата магния и др. Следует отметить, их действие длится 4-6 часов, поэтому выполнения перевязки 1 раз в сутки явно недостаточно.
Гораздо большей гидрофильностью обладают нашедшие в последнее время мази на основе полиэтиленгликоля: левосин, леворин, диоксиколь и др., которые также содержат левомицетин, сульфаниламидные препараты различной продолжительности действия, обезболивающее вещество - тримекаин. Мази обеспечивают высокую дегидратацию, антибактериальное действие и местное обезболивание в течение 24-48 часов. Для лечения ожоговых ран все большее применение находят другие лекарственные препараты на основе полиэтиленгликоля: левомизоль, олазоль, оксициклозоль и др.
Помимо использования различных видов дренирования, в современной хирургии все большее применение находят и другие методы физической антисептики, к которым относятся:
1. Открытое ведение ран обычно применяется при лечении ожогов. Больные находятся в палатах с высокой температурой и малой влажностью. При этом на ране образуется струп – своеобразная биологическая повязка и организмы погибают под воздействием факторов местного иммунитета.
2. Изоляторы с абактериальной воздушной средой используются для лечения тяжелых форм гнойной инфекции, распространенных термических ожогов. Установка для лечения в абактериальной среде состоит из компрессора и вентилятора для продувания воздуха, бактериального фильтра и камеры со стерильной средой, куда помещают больного или пораженную часть тела. Существует два основных типа абактериальных изоляторов: общие - палаты или операционные с ламинарным потоком стерильного воздуха и местные - изоляторы для участка тела. Рана в изоляторе находится без повязки.
3. Гипербарическая оксигенация нашла свое применение при лечении анаэробной клостридиальной и неклостридиальной, тяжелых форм гнойной и гнилостной инфекции. Создание повышенного парциального давления кислорода от 1,5 до 3 атм. наряду со специфическим лечением способствует быстрому подавлению жизнедеятельности микрофлоры, а также предупреждает прогрессирующий некробиоз тканей.
4. Ультрафиолетовое излучение используется для уничтожения микробов на раневой поверхности, для облучения крови как экстракорпорально, так и внутри сосудов. Основой антисептического действия на кровь являются разнообразные фотобиологические процессы, обусловленные фотофизическими и фотохимическими реакциями после поглощения квантов света (фотонов) различными биомолекулами. Происходит изменение поверхностных мембранозависимых свойств и функций форменных элементов крови, секреция ими биологически активных веществ, влияющих на состояние различных тканей и органов. Повышается бактерицидность крови, ее фагоцитарные свойства.
5. Лазерное облучение уменьшает количество микробных ассоциаций и повышает чувствительность бактерий к антибиотикам. Наиболее часто применяют гелий - неоновый лазер (ЛГ-36, ЛГ-75), а также лазеры на СО 2 . Большая концентрация лазерного облучения на ограниченном участке приводит к испарению тканевых структур. Создается эффект быстрого одномоментного удаления гнойно-некротических тканей, благодаря чему достигается стерилизации раневой поверхности.
6. Ультразвуковая кавитация используется при лечении гнойных ран. В рану наливают раствор антисептика и вводят наконечник прибора с низкочастотными ультразвуковыми колебаниями. Под воздействием ультразвука в жидкости возникает ряд эффектов (звуковое, радиационное давление, аккустические потоки и др.), которые обеспечивают интенсивную очистку поверхности раны, проникновение раствора антисептика на глубину до 3 см. (кожа и мышцы) и до 2-3 мм в костную ткань, что подавляет способность микробов к размножению и вызывает ускорение физиологических процессов.
7. Вакуумная обработка гнойных ран за счет значительного отрицательного воздействия вызывает очищение раневой поверхности от детрита и микробных тел.
8. Сорбционный метод лечения предполагает введение в рану углеродсодержащих веществ в виде порошка или волокон, которые абсорбируют на себе токсины микроорганизмов. Наиболее часто применяется полипефан и различные вещества, предназначенные для гемосорбции и гемодиализа, например, СМУС-1.
ХИМИЧЕСКАЯ АНТИСЕПТИКА
Это метод борьбы с инфекцией в ране, основанный на применении химических веществ, которые оказывают бактерицидное и бактериостатическое действие.
Применение их может быть местным или общим.
Местное:
· наложение повязок, пропитанных антисептическим веществом на рану;
· промывание раны антисептическими веществами;
· присыпание раны химическим антисептиком;
· введение в рану тампонов, пропитанных химическим антисептиком (раствор фурациллина 1:5000, мазь А.В. Вишневского и др.);
· помещение конечности или всего тела в ванну с раствором антисептика (0,1% раствор перманганата калия);
· введение антисептика в полость через дренаж (0,1% раствор риванола и др.)
Общее:
· прием per os сульфаниламидов, нитрофуранов и др.
· внутривенное введение (метрогил, диоксидин и др.)
В зависимости от химической природы антисептические препараты разделяют на две группы:
1) неорганические соединения:
· галоиды (спиртовая настойка йода, йодонат, йодопирон, р-р Люголя, хлорамин и др.);
· окислители (3% перекись водорода, 0,02-0,1, 2-5 % перманганат калия);
· неорганические кислоты и щелочи (борная кислота, салициловая кислота и др.);
· соли тяжелых металлов (оксицианистая ртуть 1:10000, 1:50000; 0,1-2%, 5-20% нитрат серебра; протаргол и колларгол и др.);
· щелочи (нашатырный спирт);
2) органические соединения:
· спирты (этиловый);
· альдегиды (формалин, лизол и др.);
· фенолы (карболовая кислота, тройной раствор);
· красители (1-2% метиленовый синий, 1-2% бриллиантовый зеленый);
· детергенты (поверхностно-активные вещества): хлоргексидина биглюконат, церигель, дегмин, дегмицид, моющие растворы «Астра», «Новость»;
· производные нитрофурана (фурациллин, фурадонин, фуразолидон, фурагин и др.);
· сульфаниламиды (стрептоцид, норсульфазол, этазол, сульфадиметоксин, сульфален, бисептол и др.);
· производные 8-оксихинолина (нитроксолин (5-НОК), энтеросептол, интестопан);
· производные хиноксалина (диоксидин);
· производные нитроимидазола (метронидазол, метрагил, флагил, трихопол)
· дегти, смолы (деготь березовый, ихтиол, нафталан);
· антисептики растительного происхождения (хлорофиллипт, эктерицид, бализ, календула и др.)
В целях улучшения местного антисептического действия последнее время стали применять поверхностно-активные, пленкообразующие антисептические вещества в виде аэрозолей с химиопрепаратами на основе фурагина, диоксидина. Они не опасны для персонала и больного, долго не высыхают и могут создать нужную концентрацию препарата. Кроме того, привыкание к диоксидину и фурагину развивается редко.
В последние годы нашел применение камбутек - губчатое покрытие для ран из растворимого коллагена и антисептика.
БИОЛОГИЧЕСКАЯ АНТИСЕПТИКА
Сущность биологической антисептики заключается в применении методов и средств, повышающих иммунобиологические силы организма, создающих биологическую несовместимость для существования и развития микробов в ране.
К таким средствам относят:
· антибиотики;
· протеолитические ферменты;
· препараты для пассивной иммунизации: лечебные сыворотки, анатоксины, гамма-глобулины, бактериофаги, гипериммунная плазма;
· методы экстракорпоральной дезинтоксикации организма.
АНТИБИОТИКОТЕРАПИЯ
Антибиотики – вещества, являющиеся продуктами жизнедеятельности микроорганизмов, подавляющие рост и развитие определенных групп других микроорганизмов.
Основные группы антибиотиков:
1. Пенициллины:
· бензилпенициллин (природный антибиотик);
· полусинтетические пенициллины: пенициллазоустойчивые - оксациллин, метициллин, ампициллин, амоксициллин;
· комбинированные: ампиокс, аугментин, уназин.
2. Цефалоспорины: цефазолин, цефамандол, цефаклор,кефзол, цефуроксим, цефтриаксон, цефпиром.
3. Аминогликозиды: стрептомицин, гентамицин, канамицин, тобрамицин, сизомицин, амикацин, нетромицин.
4. Тетрациклины: тетрациклин, метациклин, доксициклин.
5. Макролиды: эритромицин, олеандомицин, рокситромицин, азитромицин, кларитромицин.
7. Линкосамиды: левомецитин.
8. Рифампицины: рифампицин.
9. Противогрибковые антибиотики : леворин, нистатин.
10. Полимиксин В.
11. Линкозамины: линкомицин, клиндамицин.
12. Фторхинолоны: офлоксацин, ципрофлоксацин и др.
13. Карбапенемы: импенем, меропенем.
14. Гликопептиды: ванкомицин, эремомицин, тейкопланин
15. Монбактамы: азтреноам, карумонам.
16. Хлорамфениколы : левомецитин.
17. Стрептограмины: синерцид
18 . Оксазолидиноны: линезолидом
Основные принципы антибактериальной терапии
1. Применение антибиотиков только по строгим показаниям.
2. Назначать максимальные терапевтические или при тяжелых формах инфекции субтоксические дозы антибиотиков.
3. Соблюдать кратность введения в течение суток для поддержания постоянной бактерицидной концентрации препарата в плазме крови.
4. При необходимости длительного лечения антибиотиками их надо менять каждые 5-7 дней, во избежание адаптации микрофлоры к антибиотикам.
5. Производит смену антибиотика при его неэффективности.
6. При выборе антибиотика основываться на результатах исследования чувствительности микрофлоры.
7. Учитывать синэргизм и антагонизм при назначении комбинации антибиотиков, а также антибиотиков и других антибактериальных препаратов.
8. При назначении антибиотиков обращать внимание на возможность побочных эффектов и токсичность препаратов.
9. Для профилактики осложнений аллергического ряда тщательно собирать аллергологический анамнез, в ряде случаев обязательным является проведение кожной аллергической пробы (пенициллины).
10. При длительных курсах антибиотикотерапии назначать противогрибковые препараты для профилактики дисбактериоза, а также витамины.
11. Использовать оптимальный путь введения антибиотиков.
Пути введения антибиотиков:
1. засыпание раны порошком антибиотика;
2. введение тампонов с растворами антибиотика;
3. введение через дренажи (для орошения полостей);
4. введение антибиотиков через инъекционную иглу после пункции и извлечение гноя из полостей.
5. эндотрахеальное и эндобронхиальное введение через катетер, проведенный в нос и трахею, через бронхоскоп или путем пункции трахеи;
6. обкалывание раствором антибиотика воспалительных инфильтратов (введение под инфильтрат);
7. внутрикостное введение (при остеомиелите).
8. эндолюмбальное введение (гнойный менингит);
9. внутривенное введение;
10. внутримышечное введение;
11. внутриартериальное введение применяют при тяжелых гнойных конечностей и некоторых внутренних органов - антибиотики вводят в артерию путем пункции, а при необходимости длительной внутриартериальной инфузии через катетер, введенный в соответствующую артериальную ветвь;
12. прием антибиотиков per os;
13. эндолимфатическое введение антибиотиков позволяет создавать высокую концентрацию их в органах и тканях, при воспалительном гнойном процессе.
Применяются методики:
а) прямого введения, когда просвет выделенного лимфососуда заполняют через иглу или постоянный катетер;
б) путем введения в крупные лимфоузлы;
в) подкожно в проекции лимфатических коллекторов.
Эндолимфатическое введение антибиотиков создает в 10 раз большую концентрацию его в очаге инфекции по сравнению с традиционными путями введения, что обеспечивает более быстрое купирование воспалительного процесса.
Ошибки антибиотикотерапии:
1. Применение антибиотиков без должных показаний.
2. Использование в малых дозах, что приводит к быстрой адаптации микрофлоры к антибиотикам.
3. Недоучет антибиотикорезистентности в процессе лечения.
4. Применение комбинации антибиотиков с антагонистическим действием или усугубляющих токсическое действие друг друга на организм.
5. Недоучет противопоказаний к назначению антибиотиков (отягощенный аллергологический анамнез, болезни печени, почек, гематологические заболевания и др.)
Осложнения антибиотикотерапии:
1. Аллергические реакции: анафилактический шок, синдром сывороточной болезни (высокая температура, увеличение лимфоузлов, спленомегалия, боль в сустав, ангионевротический отек, эозинофилия), крапивница, геморрагический васкулит, воспалительно-некротические поражения кожи.
2. Ототоксичность (аминогликозиды, гликопептиды).
3. Развитие нервно-мышечного блока (аминогликозиды).
4. Нефротоксическое действие (аминогликозиды, гликопептиды, цефалоспорины в высоких дозах).
5. Нарушение функции печени (стрептомицин, тетрациклины, макролиды, рифампицин)
6. Нарушение функции желудочно-кишечного тракта – рвота, понос, эрозивный гастрит, желудочно-кишечные кровотечения (макролиды, тетрациклины).
7. Угнетение гемопоэза (стрептомицин, левомецитин).
8. Тромбообразование (рифампицин)
9. Реакция обострения - токсический шок (реакция Яриша-Гексгеймера).
10. Развитие дисбактериоза, кандидомикоза вследствие размножения условно-патогенных бактерий и грибков рода Candida.
11. Среди редко встречающихся, но очень тяжелых осложнений антибиотикотерапии следует отметить псевдомембранозный колит, почти всегда заканчивающийся смертью.
Антибиотикопрофилактика
Под профилактическим применением антибиотиков в хирургии понимают их предоперационное введение с целью снижения риска развития послеоперационной раневой инфекции.
Наиболее частыми возбудителями послеоперационной раневой инфекции являются S.aureus, энтерококки, E.coli, P.aeruginosa, Enterobacter spp., P.mirabilis, K.pneumoniae. Спектр микроорганизмов определяется видом оперативного вмешательства, его продолжительностью, длительностью пребывания пациента в стационаре перед операцией, резистентностью микрофлоры к антибиотикам.
Современная концепция антибиотикопрофилактики базируется на следующих принципах:
· При проведении антибиотикопрофилактики не следует стремиться к полной эрадикации бактерий. Значительное уменьшение их числа облегчает работу иммунной системы и предотвращает развитие гнойных осложнений.
· Эффективная концентрация антибиотика в операционной ране должна быть достигнута к началу операции и сохраняться до ее окончания.
· Для большинства плановых и экстренных оперативных вмешательств оптимальным принято считать введение антибиотика во время вводного наркоза - за 30-40 мин до операции.
· Доза антибиотика при антибиотикопрофилактике соответствует обычной терапевтической дозе.
· Предпочтительным является в/в введение антибиотика, что обеспечивает его оптимальную концентрацию в сыворотке крови во время операции
· Продолжение введения антибиотика более чем через 24 ч после операции не приводит к повышению эффективности антибиотикопрофилактики.
· С точки зрения эффективности и безопасности наиболее приемлемыми антибиотикопрофилактики в хирургии являются цефалоспорины I-II поколения (цефазолин, цефуроксим) и аминопенициллины (амоксициллин/клавуланат, ампициллин/сульбактам).
Разработаны различные схемы предоперационной антибиотикопрофилактики в зависимости от вида оперативного вмешательства и предполагаемого возбудителя (табл. 1).
Доза для взрослого перед операцией
Пищевод, желудок, двенадцатиперстная кишка
Высокий риск Цефуроксим или Амоксициллин/клавуланат или Ампициллин/сульбактам
1-2 г, в/в 1,2 г, в/в 1,5 г, в/в
Толстый кишечник
Внутрь: неомицин или канамицин + эритромицин Парентерально: Амоксициллин/клавуланат Ампициллин/сульбактам
1 г 1 г 1,2 г, в/в 1,5 г, в/в
Экстренные операции
Гентамицин + Метронидазол или Амоксициллин/клавуланат или Ампициллин/сульбактам
80 мг, в/в 0,5 г, в/в 1,2 г, в/в 1,5 г, в/в
Аппендэктомия (аппендикс без перфорации)
Амоксициллин/клавуланат или Ампициллин/сульбактам
1,2 г, в/в 1,5 г, в/в
ЭНЗИМОТЕРАПИЯ
Применение протеолитических ферментов способствует быстрому очищению инфицированных ран, гнойных полостей от нежизнеспособных участков тканей, сгустков фибрина, гноя. Кроме того, они обладают противовоспалительным и противоотечным действием, повышают активность антибиотиков.
В настоящее время применяют:
1. Протеолитические ферменты животного происхождения (трипсин, плазмин, химотрипсин, химопсин, рибонуклеаза).
2. Микробные ферменты (стрептокиназа, коллагеназа, гиалуронидаза).
3. Протеолитические ферменты растительного происхождения (бромелаин, папаин, дебрицин, террилитин).
4. Ируксол – мазь, содержащая фермент клостридилпептидазу и антибиотик левомецитин.
Применение протеолитических ферментов для лечения гнойных ран и трофических язв позволяет быстрее добиться их очищения от гнойно-некротических тканей, насыщенных микробами и являющихся для них хорошей питательной средой. По существу, производится некрэктомия без применения скальпеля.
Способы применения протеолитических ферментов:
1. Внутримышечное введение
2. Местное применение.
3. Электрофорез протеолитических ферментов
4. Орошение свищей и костных полостей.
5. Внутривенное введение
6. Внутрикостное введение (при остеомиелите).
7. Ингаляционная энзимотерапия (при лечении гнойных заболеваний легких).
ПРЕПАРАТЫ ДЛЯ ПАССИВНОЙ ИММУНИЗАЦИИ
Для пассивной иммунизации наиболее часто используются следующие препараты:
1. Противостолбнячная сыворотка и противостолбнячный гамма-глобулин, столбнячный анатоксин – для профилактики и лечения столбняка.
2. Противогангренозная сыворотка – для профилактики и лечения анаэробной инфекции.
3. Антистафилококковый, антистрептококковый, антиколи-бактериофаги, поливалентный бактериофаг – для промывания и лечения гнойных ран после идентификации возбудителя.
4. Антистафилококковая и антисинегнойная гипериммунная плазма – для лечения хирургических заболеваний, вызванных стафилококком и синегнойной палочкой.
МЕТОДЫ ЭКСТРАКОРОПОРАЛЬНОЙ ДЕЗИНТОКСИКАЦИИ ОРГАНИЗМА
Дезинтоксикация - это нейтрализация или выведение токсинов из организма. В настоящее время применяются следующие методы дезинтоксикации:
1. Экстракорпоральная гемосорбция . Сущность метода заключается в непосредственном контакте циркулирующей крови в специальном устройстве (аппарате) с поверхностью сорбента (активированного угля), что приводит к нейтрализации микробных и тканевых токсинов.
2. Лимфосорбция – позволяет удалить токсины, накапливающиеся в лимфатической системе. С этой целью производится катетеризация грудного лимфатического протока.
3. Гемодиализ – в основе метода лежат процессы диффузии и ультрафильтрации в аппарате «Искусственная почка», что приводит к удалению азотистых шлаков и токсинов. Наряду с этим. ультрафильтрация позволяет удалить избыток жидкости за счет создания вакуума с внешней стороны диализной мембраны.
ЛИТЕРАТУРА:
1. Антибактериальная терапия абдоминальной хирургической инфекции. Под ред акад. Савельева В.С. – М., 2002. – 140 с.
2. Афиногенов Т.Е., Елинов Н.П. Антисептика в хирургии. - Л.:Медицина, 1987.
3. Веденко Б.Г.Старшая медицинская сестра. - Киев, Здоровья, 1986. - с.17
4. Внутрибольничные инфекции: под ред. Венцела В.П.- М.:Медицина, 1990. – 212 с.
5. Волколаков Я.В. Общая хирургия. - Рига: Звайгзне, 1989. - с.32-77.
6. Горбачев В.Н. Вопросы для программированного контроля знаний по общей хирургии. – Тюмень: Издательство Тюменского госуниверситета, 2002. – 208 с.
7. Гостищев В.К. Общая хирургия. - М.: ГЕОТАР-МЕД, 2002 – 608 с.
8. Клиническая фармакология противомикробных и противовирусных средств. – Тюмень: издательский центр «Академия», 2002. – 74 с.
9. Красильников А.П. Справочник по антисептике. - Минск, 1995. - 367с.
10. Малярчук В.И., Пауткин Ю.Ф. Курс лекций по общей хирургии. – М.: Изд-во РУДН, 1999. – 379 с.
11. Общая хирургия: под ред. Шмита В., Хартига В., Кузина М.И. - М.: Медицина, 1985. - с.5-48.
12. Папкин К.В., Пауткин Ю.Ф. Основы общей хирургии (руководство к практическим занятиям) - М, 1992. – с. 28-40.
13. Петров С.В. Общая хирургия. – СПб: Питер, 2002. – 768 с.
14. Практическое руководство по антиинфекционной химиотерапии. Под ред. Страчунского Л.С. и соавт. – М., 2002.
15. Приказ N 720-78 МЗ СССР.
16. Серебрянцев В.К. Некоторые частные вопросы общей хирургии. - М.:"Кругъ", 1994. - с.47-50.
17. Сидоренко С.В., Яковлев С.В. Инфекции в интенсивной терапии. М., 2000.
18. Сэнфорд Дж. и др. Антимикробная терапия. (пер. с англ.) - М.: Практика, 1996.
19. Тимофеев Н.С. , Тимофеев Н.Н. Асептика и антисептика. – Л.: Медицина, 1989. - 238 с.
20. Тимофеев Н.С., Тимофеев Н.Н. Перевязочная. - М.: Медицина, 1987. – с.6-22.
21. Усов Д.В. Избранные лекции по общей хирургии. - Тюмень, 1995.