Alkeene iseloomustavad peamiselt reaktsioonid ühinemine topeltsideme kaudu. Põhimõtteliselt kulgevad need reaktsioonid ioonmehhanismi abil. Pi side katkeb ja moodustub kaks uut sigma sidet. Tuletan meelde, et asendusreaktsioonid olid alkaanidele tüüpilised ja järgisid radikaalset mehhanismi. Vesinikumolekulid võivad kinnituda alkeenidega; neid reaktsioone nimetatakse hüdrogeenimiseks, veemolekulideks, hüdratsiooniks, halogeenide halogeenimiseks, vesinikhalogeniidide hüdrohalogeenimiseks. Aga kõigepealt asjad kõigepealt.
Topeltsideme liitumisreaktsioonid
Niisiis, esiteks keemiline omadus vesinikhalogeniidide lisamise võime, hüdrohalogeenimine.
Propeen ja teised alkeenid reageerivad Markovnikovi reegli kohaselt vesinikhalogeniididega.

Vesinikuaatom kinnitub kõige enam hüdrogeenitud või õigemini hüdrogeenitud süsinikuaatomiga.
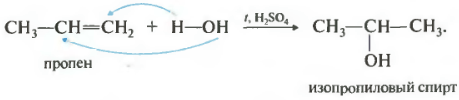
Teiseks number meie omaduste nimekirjas oleks hüdratatsioon, vee lisamine.
Reaktsioon toimub kuumutamisel happe, tavaliselt väävel- või fosforhappe manulusel. Vee lisamine toimub ka Markovnikovi reegli järgi, see tähendab, et primaarset alkoholi saab saada ainult etüleeni hüdraatimisel, ülejäänud hargnemata alkeenid annavad sekundaarseid alkohole.
Markovnikovi reeglist on erandeid nii hüdrohalogeenimise kui ka hüdratatsiooni kohta. Esiteks, vastupidiselt sellele reeglile, lisamine toimub peroksiidide juuresolekul.
Teiseks alkeenide derivaatide puhul, milles esinevad elektrone tõmbavad rühmad. Näiteks 3,3,3-trifluoropropeen-1 jaoks.

Fluori aatomid tõmbavad oma suure elektronegatiivsuse tõttu sigma sidemete ahela kaudu enda poole elektrontihedust. Seda nähtust nimetatakse negatiivseks induktiivseks efektiks.

Seetõttu nihkuvad kaksiksideme liikuvad pi-elektronid ja kõige välimine süsinikuaatom saab osalise positiivse laenguga, mida tavaliselt tähistatakse kui delta pluss. Just sellele läheb negatiivselt laetud broomiioon ja vesiniku katioon kinnitub kõige vähem hüdrogeenitud süsinikuaatomiga.
Lisaks trifluorometüülrühmale omavad negatiivset induktsiooniefekti näiteks triklorometüülrühm, nitrorühm, karboksüülrühm ja mõned teised.
See teine Markovnikovi reegli rikkumise juhtum ühtsel riigieksamil on väga haruldane, kuid siiski on soovitatav seda meeles pidada, kui plaanite eksami sooritada maksimaalse punktisummaga.
Kolmandaks halogeeni molekulide keemilised omadused.

See puudutab peamiselt broomi, kuna see reaktsioon on mitme sideme korral kvalitatiivne. Kui näiteks etüleen lastakse läbi broomivee, st broomi lahuse vees, mis on pruuni värvi, muutub see värvituks. Kui lasete gaaside segu, näiteks etaani ja eteeni, läbi broomivee, saate puhta etaani ilma eteeni lisanditeta, kuna see jääb reaktsioonikolbi dibromoetaani kujul, mis on vedelik.
Eriti tähelepanuväärne on alkeenide reaktsioon gaasifaasis tugeva kuumutamisega, näiteks klooriga.
Sellistes tingimustes ei toimu mitte liitumisreaktsioon, vaid asendusreaktsioon. Veelgi enam, eranditult alfa-süsinikuaatomi juures, st kaksiksidemega külgneval aatomil. Sel juhul saadakse 3-kloropropeen-1. Neid reaktsioone esineb eksamil harva, mistõttu enamik õpilasi ei mäleta neid ja reeglina teevad vigu.
Neljandaks number on hüdrogeenimisreaktsioon ja koos sellega ka dehüdrogeenimisreaktsioon. See tähendab vesiniku lisamist või eemaldamist.

Hüdrogeenimine toimub nikkelkatalüsaatoril mitte väga kõrgel temperatuuril. Kõrgematel temperatuuridel on alküünide saamiseks võimalik dehüdrogeenida.
Viiendaks Alkeenide omadus on polümeriseerumisvõime, kui sajad ja tuhanded alkeeni molekulid moodustavad pi-sideme katkemise ja üksteisega sigma-sidemete tekkimise tõttu väga pikki ja tugevaid ahelaid.
Sel juhul oli tulemuseks polüetüleen. Pange tähele, et saadud molekul ei sisalda mitut sidet. Selliseid aineid nimetatakse polümeerideks, algmolekule nimetatakse monomeerideks, korduv fragment on polümeeri elementaarühik ja arv n on polümerisatsiooniaste.
Võimalikud on ka reaktsioonid muude oluliste polümeersete materjalide, näiteks polüpropüleeni tootmiseks.


Teine oluline polümeer on polüvinüülkloriid.

Selle polümeeri tootmise lähteaineks on kloroetaan, mille üldnimetus on vinüülkloriid. Kuna seda küllastumata asendajat nimetatakse vinüüliks. Plasttoodetel sageli esinev lühend PVC tähistab polüvinüülkloriidi.
Arutasime viit omadust, mis esindasid kaksiksideme liitumisreaktsioone. Vaatame nüüd reaktsioone oksüdatsioon.
Alkeenide oksüdatsioonireaktsioonid
Kuues keemiline omadus meie üldnimekirjas on kerge oksüdatsioon või Wagneri reaktsioon. See tekib siis, kui alkeen puutub külma käes kokku kaaliumpermanganaadi vesilahusega, mistõttu on eksamiülesannetes sageli märgitud null kraadine temperatuur.
Tulemuseks on kahehüdroksüülne alkohol. Sel juhul nimetatakse etüleenglükooli ja üldiselt selliseid alkohole ühiselt glükoolideks. Reaktsiooni käigus muutub lillakasroosa permanganaadi lahus värvust, seega on see reaktsioon kvalitatiivne ka kaksiksideme jaoks. Mangaan taandub neutraalses keskkonnas oksüdatsiooniastmelt +7 oksüdatsiooniastmeni +4. Vaatame veel paar näidet. VÕRRAND
Siin saame propaandiool-1,2. Kuid tsüklilised alkeenid reageerivad samal viisil. VÕRRAND
Teine võimalus on see, kui kaksikside asub näiteks aromaatsete süsivesinike külgahelas. Wagneri reaktsiooni, mis hõlmab stüreeni, selle teine nimi on vinüülbenseen, kohtab eksamiülesannetes regulaarselt.

Loodan, et olen toonud teile piisavalt näiteid, et mõistaksite, et kaksiksideme kerge oksüdeerimine toimub alati üsna lihtsa reegli järgi: pi-side katkeb ja igale süsinikuaatomile lisatakse hüdroksüülrühm.
Nüüd kõva oksüdatsiooni kohta. See saab olema meie oma seitsmes vara. See oksüdatsioon toimub siis, kui alkeen reageerib kuumutamisel happelise kaaliumpermanganaadi lahusega.
Toimub molekuli hävimine, see tähendab selle hävimine kaksiksideme juures. Buteen-2 puhul saadi kaks äädikhappe molekuli. Üldiselt saab mitmiksideme asukohta süsinikuahelas hinnata oksüdatsiooniproduktide põhjal.
Buteen-1 oksüdeerimisel tekib propioonhappe (propaanhappe) ja süsinikdioksiidi molekul.
Etüleeni puhul saate kaks süsinikdioksiidi molekuli. Happelises keskkonnas väheneb mangaan kõigil juhtudel oksüdatsiooniastmelt +7 kuni +2.
Ja lõpuks kaheksas omadus täielik oksüdatsioon või põlemine.
Alkeenid põlevad, nagu ka teised süsivesinikud, süsinikdioksiidiks ja veeks. Kirjutame üles alkeenide põlemise võrrandi üldkujul.
Süsinikdioksiidi molekule on sama palju kui alkeeni molekulis on süsiniku aatomeid, kuna CO 2 molekul sisaldab ühte süsinikuaatomit. See tähendab n CO 2 molekuli. Veemolekule on kaks korda vähem kui vesinikuaatomeid, see tähendab 2n/2, mis tähendab vaid n.
Vasakul ja paremal on sama palju hapnikuaatomeid. Paremal on 2n süsihappegaasi pluss n vett, kokku 3n. Vasakul on sama arv hapnikuaatomeid, mis tähendab, et molekule on kaks korda vähem, kuna molekul sisaldab kahte aatomit. See tähendab 3n/2 hapniku molekuli. Saate kirjutada 1,5n.
Oleme üle vaadanud kaheksa alkeenide keemilised omadused.
Uurime välja, mis on alkeeni hüdratatsioonireaktsioon. Selleks kirjeldame lühidalt seda süsivesinike klassi.
Üldvalem
Alkeenid on küllastumata orgaanilised ühendid üldvalemiga SpH2n, mille molekulidel on üks kaksikside ja mis sisaldavad ka üksik(lihtsaid) sidemeid. Süsinikuaatomid on sp2 hübriidses olekus. Selle klassi esindajaid nimetatakse etüleeniks, kuna selle seeria esivanem on etüleen.
Nomenklatuuri tunnused
Alkeenide hüdratatsiooni mehhanismi mõistmiseks on vaja esile tuua nende nimede tunnused. Süstemaatilise nomenklatuuri järgi kasutatakse alkeeni nimetamisel teatud toimingute algoritmi.
Esiteks peate määrama pikima süsinikuahela, mis sisaldab kaksiksidet. Numbrid näitavad süsivesinikradikaalide asukohta, alustades vene tähestiku väikseimast.
Kui molekulis on mitu identset radikaali, lisatakse nimele kvalifitseerivad eesliited di-, tri- ja tetra.
Alles selle järgi nimetatakse süsinikuaatomite ahelat ennast, lisades lõppu järelliide -een. Küllastumata (kaksik)sideme asukoha selgitamiseks molekulis tähistatakse seda numbriga. Näiteks 2metüülpenteen-2.

Hübridiseerumine alkeenides
Järgmist tüüpi ülesandega toimetulemiseks: "Kehtestada alkeeni molekulvalem, mille hüdraatimisel tekkis sekundaarne alkohol", on vaja välja selgitada selle süsivesinike klassi esindajate struktuurilised omadused. Kaksiksideme olemasolu selgitab CxHy võimet osaleda liitumisreaktsioonides. Kaksiksidemete vaheline nurk on 120 kraadi. Küllastumata sidemes pöörlemist ei täheldata, seetõttu iseloomustab selle klassi esindajaid geomeetriline isomeeria. Alkeenmolekulide peamine reaktsioonikoht on kaksikside.

Füüsikalised omadused
Need on sarnased küllastunud süsivesinikega. Selle orgaaniliste süsivesinike klassi madalamad esindajad on normaalsetes tingimustes gaasilised ained. Järgmisena täheldatakse järkjärgulist üleminekut vedelikele ja alkeene, mille molekulid sisaldavad rohkem kui seitseteist süsinikuaatomit, iseloomustab tahke olek. Kõik selle klassi ühendid lahustuvad vees ebaoluliselt, samas kui nad lahustuvad suurepäraselt polaarsetes orgaanilistes lahustites.
Isomeeria tunnused
Etüleenühendite esinemine molekulides selgitab nende struktuurivalemite mitmekesisust. Lisaks süsiniku skeleti isomerisatsioonile, mis on iseloomulik kõigi orgaaniliste ühendite klasside esindajatele, on neil klassidevahelised isomeerid. Need on tsükloparafiinid. Näiteks propeeni puhul on klassidevaheliseks isomeeriks tsüklopropaan.
Kaksiksideme olemasolu selle klassi molekulides selgitab geomeetrilise cis- ja trans-isomeeria võimalust. Sellised struktuurid on võimalikud ainult sümmeetriliste küllastumata süsivesinike puhul, mis sisaldavad kaksiksidet.
Selle isomeeria variandi olemasolu määrab süsinikuaatomite vaba pöörlemise võimatus piki kaksiksidet.

Keemiliste omaduste eripära
Alkeeni hüdratatsiooni mehhanismil on teatud omadused. See reaktsioon viitab elektrofiilsele liitumisele.
Kuidas toimub alkeeni hüdratatsioonireaktsioon? Sellele küsimusele vastamiseks kaaluge Markovnikovi reeglit. Selle olemus seisneb selles, et asümmeetrilise struktuuriga alkeenide hüdratsioon viiakse läbi teatud viisil. Vesinikuaatom kinnitub süsinikuga, mis on rohkem hüdrogeenitud. Hüdroksüülrühm on seotud süsinikuaatomiga, milles on vähem H. Alkeenide hüdratsioon viib sekundaarsete ühehüdroksüülsete alkoholide moodustumiseni.
Reaktsiooni täielikuks kulgemiseks kasutatakse katalüsaatoritena mineraalhappeid. Need tagavad vajaliku koguse vesinikkatioonide sisestamise reaktsioonisegusse.
Primaarseid ühehüdroksüülseid alkohole on alkeenide hüdraatimisel võimatu saada, kuna Markovnikovi reeglit ei järgita. Seda omadust kasutatakse sekundaarsete alkoholide orgaanilises sünteesis. Alkeenide igasugune hüdratsioon viiakse läbi ilma karme tingimusi kasutamata, seega on protsess leidnud oma praktilise kasutuse.
Kui SpH2n klassi esialgne esindaja on etüleen, siis Markovnikovi reegel ei tööta. Milliseid alkohole ei saa alkeenide hüdraatimisel saada? Sellise keemilise protsessi tulemusena on ebasümmeetrilistest alkeenidest primaarseid alkohole võimatu saada. Kuidas kasutatakse alkeenide hüdraatimist? Sekundaarsete alkoholide tootmine toimub täpselt sel viisil. Kui süsivesinikuks valitakse atsetüleeni seeria (alküünid) esindaja, põhjustab hüdratatsioon ketoonide ja aldehüüdide tootmist.

Markovnikovi reegli kohaselt viiakse läbi alkeenide hüdratiseerimine. Reaktsioonil on elektrofiilne liitmismehhanism, mille olemust on hästi uuritud.
Toome selliste teisenduste kohta mitu konkreetset näidet. Milleni alkeenide hüdratatsioon viib? Kooli keemiakursustel pakutud näited näitavad, et propeen-2 võib saada propeenist, reageerides veega, ja butanool-2 saab buteen-1-st.
Alkeenhüdraatimist kasutatakse kaubanduslikult. Sel viisil saadakse sekundaarsed alkoholid.

Halogeenimine
Küllastumata süsivesinike koostoimet halogeenmolekulidega peetakse kvalitatiivseks reaktsiooniks kaksiksidemele. Oleme juba analüüsinud, kuidas alkeenide hüdratsioon toimub. Halogeenimise mehhanism on sarnane.
Halogeeni molekulidel on kovalentne mittepolaarne keemiline side. Kui ilmnevad ajutised kõikumised, muutub iga molekul elektrofiilseks. Selle tulemusena suureneb liitumise tõenäosus, millega kaasneb kaksiksideme hävimine küllastumata süsivesinike molekulides. Pärast protsessi lõppu on reaktsiooniproduktiks alkaani dihalogeenderivaat. Broomimist peetakse kvalitatiivseks reaktsiooniks küllastumata süsivesinikele, kuna halogeeni pruun värvus kaob järk-järgult.

Hüdrohalogeenimine
Oleme juba vaadanud, milline on alkeenide hüdratatsiooni valem. Reaktsioonidel vesinikbromiidiga on sarnane võimalus. Sellel anorgaanilisel ühendil on kovalentne polaarne keemiline side, mistõttu toimub elektronide tiheduse nihe elektronegatiivsema broomi aatomi suunas. Vesinik omandab osalise positiivse laengu, andes halogeenile elektroni ja ründab alkeeni molekuli.
Kui küllastumata süsivesinikul on asümmeetriline struktuur, tekib vesinikhalogeniidiga reageerimisel kaks produkti. Seega saadakse propeenist hüdrohalogeenimisel 1-bromoproaan ja 2-bromopropaan.
Interaktsioonivõimaluste esialgseks hindamiseks võetakse arvesse valitud asendaja elektronegatiivsust.
Oksüdatsioon
Küllastumata süsivesinike molekulidele omane kaksikside puutub kokku tugevate oksüdeerivate ainetega. Samuti on nad oma olemuselt elektrofiilsed ja neid kasutatakse keemiatööstuses. Eriti huvitav on alkeenide oksüdeerimine kaaliumpermanganaadi vesilahusega (või nõrgalt leeliselise) lahusega. Seda nimetatakse hüdroksüülimisreaktsiooniks, kuna selle tulemuseks on kahehüdroksüülsed alkoholid.
Näiteks kui etüleenmolekulid oksüdeeritakse kaaliumpermanganaadi vesilahusega, saadakse etiendiool-1,2 (etüleenglükool). Seda koostoimet peetakse kvalitatiivseks reaktsiooniks kaksiksidemele, kuna interaktsiooni ajal täheldatakse kaaliumpermanganaadi lahuse värvimuutust.
Happelises keskkonnas (karmides tingimustes) võib reaktsioonisaaduste hulgas märkida aldehüüdi.
Suheldes atmosfäärihapnikuga, oksüdeerub vastav alkeen süsihappegaasiks ja veeauruks. Protsessiga kaasneb soojusenergia vabanemine, nii et tööstuses kasutatakse seda soojuse tootmiseks.
Kaksiksideme olemasolu alkeeni molekulis näitab hüdrogeenimisreaktsioonide esinemise võimalust selles klassis. SpH2n interaktsioon vesiniku molekulidega toimub siis, kui plaatinat ja niklit kasutatakse termiliselt katalüsaatoritena.
Paljud alkeeniklassi esindajad on altid osoonimisele. Madalatel temperatuuridel reageerivad selle klassi esindajad osooniga. Protsessiga kaasneb kaksiksideme lõhustumine, tsükliliste peroksiidühendite, mida nimetatakse osoniidideks, moodustumine. Nende molekulid sisaldavad O-O sidemeid, seega on ained plahvatusohtlikud. Osoniidid ei sünteesita puhtal kujul, need lagundatakse hüdrolüüsi teel, seejärel redutseeritakse tsingiga. Selle reaktsiooni produktid on karbonüülühendid, mille teadlased eraldavad ja tuvastavad.

Polümerisatsioon
See reaktsioon hõlmab mitme alkeeni molekuli (monomeeri) järjestikust kombineerimist suureks makromolekuliks (polümeeriks). Algsest eteenist toodetakse polüetüleeni, millel on tööstuslikud rakendused. Polümeer on aine, millel on kõrge molekulmass.
Makromolekuli sees on teatud arv korduvaid fragmente, mida nimetatakse struktuuriüksusteks. Etüleeni polümerisatsiooniks loetakse rühma - CH2-CH2- struktuuriüksuseks. Polümerisatsiooniaste näitab polümeeri struktuuris korduvate ühikute arvu.
Polümerisatsiooniaste määrab polümeerühendite omadused. Näiteks lühikese ahelaga polüetüleen on vedelik, millel on määrdeomadused. Pikkade ahelatega makromolekuli iseloomustab tahke olek. Materjali paindlikkust ja plastilisust kasutatakse torude, pudelite ja kilede valmistamisel. Polüetüleen, mille polümerisatsiooniaste on viis kuni kuus tuhat, on suurendanud tugevust, seetõttu kasutatakse seda tugevate niitide, jäikade torude ja valatud toodete valmistamisel.
Praktilise tähtsusega alkeenide polümerisatsioonil saadud toodete hulgast tõstame esile polüvinüülkloriidi. See ühend saadakse vinüülkloriidi polümerisatsioonil. Saadud tootel on väärtuslikud tööomadused. Seda iseloomustab suurenenud vastupidavus agressiivsetele kemikaalidele, see on mittesüttiv ja kergesti värvitav. Mida saab valmistada polüvinüülkloriidist? Portfellid, vihmamantlid, õliriie, kunstnahk, kaablid, elektrijuhtmete isolatsioon.
Teflon on tetrafluoroetüleeni polümerisatsiooni saadus. See orgaaniline inertne ühend on vastupidav järskudele temperatuurimuutustele.
Polüstüreen on elastne läbipaistev aine, mis moodustub algse stüreeni polümerisatsioonil. See on raadio- ja elektrotehnika dielektrikute valmistamisel asendamatu. Lisaks kasutatakse polüstüreeni suurtes kogustes happekindlate torude, mänguasjade, kammide ja poorsete plastide tootmiseks.
Alkeenide saamise tunnused
Selle klassi esindajad on kaasaegses keemiatööstuses nõudlikud, seetõttu on välja töötatud erinevad meetodid nende tööstuslikuks ja laboratoorseks tootmiseks. Etüleeni ja selle homolooge looduses ei eksisteeri.
Paljud laborivõimalused selle süsivesinike klassi esindajate saamiseks hõlmavad pöördliitmisreaktsioone, mida nimetatakse elimineerimiseks. Näiteks parafiinide (küllastunud süsivesinike) dehüdrogeenimisel tekivad vastavad alkeenid.
Alkaanide halogeenderivaatide reageerimisel metallilise magneesiumiga on võimalik saada ka ühendeid üldvalemiga SpH2n. Elimineerimine toimub Zaitsevi reegli järgi, mis on Markovnikovi reegli pöördväärtus.
Tööstuslikes kogustes toodetakse õli krakkimise teel etüleeni seeria küllastumata süsivesinikke. Nafta ja gaasi krakkimisel ja pürolüüsil tekkivad gaasid sisaldavad kümme kuni kakskümmend protsenti küllastumata süsivesinikke. Reaktsiooniproduktide segu sisaldab nii parafiine kui ka alkeene, mis eraldatakse üksteisest fraktsioneeriva destilleerimisega.
Mõned rakendused
Alkeenid on oluline orgaaniliste ühendite klass. Nende kasutamise võimalus on seletatav nende suurepärase reaktsioonivõime, valmistamise lihtsuse ja mõistlike kuludega. Arvukate alkeene kasutavate tööstussektorite hulgast tõstame esile polümeeritööstuse. Polümeerühendite tootmiseks kulutatakse tohutul hulgal etüleeni, propüleeni ja nende derivaate.
Seetõttu on küsimused alkeensüsivesinike tootmise uute võimaluste otsimise kohta nii olulised.
Polüvinüülkloriidi peetakse üheks kõige olulisemaks alkeenidest saadavaks tooteks. Seda iseloomustab keemiline ja termiline stabiilsus ning madal süttivus. Kuna see aine ei lahustu mineraalsetes lahustites, kuid lahustub orgaanilistes lahustites, saab seda kasutada erinevates tööstussektorites.
Selle molekulmass on mitusada tuhat. Kui temperatuur tõuseb, on aine võimeline lagunema, millega kaasneb vesinikkloriidi eraldumine.
Eriti huvitavad on selle dielektrilised omadused, mida kasutatakse kaasaegses elektrotehnikas. Tööstusharudest, kus polüvinüülkloriidi kasutatakse, tõstame esile kunstnaha tootmist. Saadud materjal ei ole jõudlusomaduste poolest sugugi halvem looduslikust materjalist ja on samal ajal palju madalama hinnaga. Sellisest materjalist rõivad on muutumas üha populaarsemaks moeloojate seas, kes loovad erksaid ja värvikaid kollektsioone erinevates värvides polüvinüülkloriidist valmistatud noorterõivastest.
Polüvinüülkloriidi kasutatakse suurtes kogustes külmikute hermeetikuna. Tänu oma elastsusele ja vastupidavusele on see keemiline ühend nõutud kilede ja kaasaegsete pinglagede valmistamisel. Pestav tapeet on lisaks kaetud õhukese PVC kilega. See võimaldab lisada neile mehaanilist tugevust. Sellised viimistlusmaterjalid on ideaalne võimalus kontoriruumide kosmeetiliseks renoveerimiseks.
Lisaks põhjustab alkeenide hüdratatsioon primaarsete ja sekundaarsete ühehüdroksüülsete alkoholide moodustumist, mis on suurepärased orgaanilised lahustid.
Alkeenid on aktiivsem ainete klass kui alkaanid. Alkeenide keemilised omadused on määratud nende molekulide struktuuriga.
Struktuur
Küllastumata süsivesinikud – alkeenid või olefiinid – erinevad teistest orgaaniliste ainete klassidest kahe- või π-sideme olemasolu poolest süsinikuaatomite vahel. Kaksikside võib paikneda ükskõik kus molekulis.
Pi-side tekib p-orbitaalide kattumisel. Tulenevalt asjaolust, et p-orbitaalil on teljest mõlemas suunas pikendused ja see meenutab hantlit, tekib pi-side kahes kohas. Erinevalt σ sidemest, mis tekib siis, kui s orbitaalid kattuvad sfääri kujul, on π side vähem tugev ja muude ühendite poolt kergesti hävitatav. See määrab alkeenide aktiivsuse.

Riis. 1. π-side ja σ-side.
Kaksikside toimib liitumisreaktsioonides elektronidoonorina. Seetõttu iseloomustavad alkeene elektrofiilsed liitumisreaktsioonid.
Füüsikalised omadused
Alkeenide üldised füüsikalised omadused:
- sulamis- ja keemistemperatuurid suurenevad molekulmassi suurenemisega homoloogses seerias;
- ei lahustu vees;
- kleepuvad veepinnale, sest nende tihedus on mitu korda väiksem kui vee tihedus;
- lahustuvad orgaanilistes lahustites - alkoholides, eetrites.
Ainete agregatsiooni olek varieerub sõltuvalt süsinikuaatomite arvust homoloogses reas. 2-4 süsinikuaatomiga alkeenid on gaasid. Alates pepteenist (C 5 H 10) kuni heptadetseeni (C 17 H3 4) on ained vedelas olekus. Rohkem kui 17 süsinikuaatomit sisaldavad alkeenid on tahked ained.

Riis. 2. Alkeenide homoloogne seeria.
Keemilised omadused
Alkeenide omadused ja näited keemiliste omaduste kohta on toodud tabelis.
|
Reaktsioon |
Kirjeldus |
Reaktsioonivõrrandid |
|
Hüdrogeenimine – vesiniku lisamine |
See tekib kõrgel rõhul katalüsaatori - nikli, pallaadiumi või plaatina - juuresolekul. Moodustuvad alkaanid - küllastunud süsivesinikud |
CH2 =CH-CH3 + H2 → CH3-CH2-CH3 |
|
Halogeenimine – halogeenide lisamine |
Tekib tavatingimustes. Halogeenid lisanduvad kaksiksideme kaudu. Tekivad dihaloalkaanid |
CH2 =CH2 + Cl2 → Cl-CH2-CH2-CI (1,2-dikloroetaan); CH3-CH=CH-CH3 + Br2 → CH3-CH-Br-CH-Br-CH3 (2,3-dibromobutaan) |
|
Hüdrohalogeenimine – vesinikhalogeniidide lisamine |
Elektrofiilne liitumisreaktsioon. Elektrofiil on vesiniku prooton halogeenis. Moodustuvad haloalkaanid |
CH2 =CH2 + HCl → CH3-CH2-Cl (kloroetaan) |
|
Niisutamine – vee lisamine |
Reaktsioon toimub anorgaaniliste hapete – väävel- ja fosforhapete – juuresolekul. Need toimivad katalüsaatorina ja on vesiniku allikad. Moodustuvad ühehüdroksüülsed alkoholid |
CH2 =CH2 + H20 → CH3-CH2OH |
|
Polümerisatsioon - aatomite arvu suurendamine |
Tekib katalüsaatori juuresolekul kõrgendatud rõhul ja temperatuuril. Sel viisil toodetakse polüetüleeni, polüvinüülkloriidi, polüpropüleeni |
nCH2 =CH2 → (-CH2-CH2-)n |
|
Tekib liigse hapnikusisalduse korral |
CH2 =CH2 + 3O2 → 2CO2 + H2O |
|
|
Mittetäielik oksüdatsioon |
Tekib katalüsaatori juuresolekul. Hapnikuga segatud alkeen juhitakse üle kuumutatud hõbeda. Tekib epoksiid - alkeenoksiid |
2CH2 =CH2 + O2 → 2CH2-O-CH2 |
|
Wagneri reaktsioon |
Oksüdeerimine kaaliumpermanganaadiga aluselises või neutraalses keskkonnas. Alkoholid tekivad |
3CH2 =CH2 + 2KMnO4 + 4H2O → 3CH2OH-CH2OH + 2KOH + 2MnO2 |
|
Oksüdeerimine keeva kaaliumpermanganaadiga happelises keskkonnas |
Karboksüülhapped moodustuvad |
CH3-CH=CH-CH3 + 4[O] → 2CH3COOH |
Katalüsaatori juuresolekul kuumutamisel läbivad alkeenid isomeerimisreaktsiooni. Kaksiksideme asend ehk süsinikskeleti struktuur muutub. Näiteks buteen-1 (kaksiksideme asend esimese ja teise aatomi vahel) muutub buteen-2-ks (kaksiksidem "nihutatakse" teise aatomi poole).

Riis. 3. Alkeenide isomerisatsioon.
Mida me õppisime?
10. klassi keemiatunnist õppisime alkeenide keemilisi omadusi. Kaksikside muudab need ained aktiivsemaks kui alkaanid. Alkeenid interakteeruvad halogeenide, hapniku, vee, vesiniku ja vesinikhalogeniididega. Enamik reaktsioone toimub katalüsaatori juuresolekul kõrgel temperatuuril või kõrgendatud rõhul. Alkeenid toodavad polümeere. Isomeerid tekivad ka katalüsaatorite mõjul.
Test teemal
Aruande hindamine
Keskmine hinne: 4.6. Kokku saadud hinnanguid: 64.
Alkeenid on keemiliselt aktiivsed. Nende keemilised omadused on suuresti määratud kaksiksideme olemasoluga. Kõige tavalisemad alkeenide reaktsioonid on elektrofiilsed liitumisreaktsioonid ja radikaalide liitumisreaktsioonid. Nukleofiilsed liitumisreaktsioonid nõuavad tavaliselt tugeva nukleofiili olemasolu ja ei ole alkeenidele tüüpilised. Alkeenid läbivad kergesti oksüdatsiooni- ja liitumisreaktsioone ning on samuti võimelised asendama alüülradikaale.
Lisamisreaktsioonid
Hüdrogeenimine Vesiniku lisamine (hüdrogeenimisreaktsioon) alkeenidele viiakse läbi katalüsaatorite juuresolekul. Kõige sagedamini kasutatakse purustatud metalle - plaatinat, niklit, pallaadiumi jne. Selle tulemusena moodustuvad vastavad alkaanid (küllastunud süsivesinikud).
$CH_2=CH_2 + H2 → CH_3–CH_3$
Halogeenide lisamine. Alkeenid reageerivad tavatingimustes kergesti kloori ja broomiga, moodustades vastavad dihaloalkaanid, milles halogeeniaatomid asuvad külgnevate süsinikuaatomite juures.
Märkus 1
Kui alkeenid interakteeruvad broomiga, muutub broomi värvus kollakaspruuniks. See on üks vanimaid ja lihtsamaid küllastumata süsivesinike kvalitatiivseid reaktsioone, kuna ka alküünid ja alkadieenid reageerivad sarnaselt.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
Vesinikhalogeniidide lisamine. Etüleensüsivesinike interakteerumisel vesinikhalogeniididega ($HCl$, $HBr$) tekivad haloalkaanid, reaktsiooni suund sõltub alkeenide struktuurist.
Etüleeni või sümmeetriliste alkeenide puhul toimub liitumisreaktsioon ühemõtteliselt ja põhjustab ainult ühe produkti moodustumist:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
Asümmeetriliste alkeenide korral on võimalik kahe erineva liitumisreaktsiooni produkti moodustumine:
Märkus 2
Tegelikult moodustub peamiselt ainult üks reaktsiooniprodukt. Selliste reaktsioonide suuna mustri kehtestas vene keemik V.V. Markovnikov aastal 1869 Seda nimetatakse Markovnikovi valitsemiseks. Kui vesinikhalogeniidid reageerivad ebasümmeetriliste alkeenidega, lisatakse vesinikuaatom kaksiksideme lõhustumise kohale kõige hüdrogeenitud süsinikuaatomil, st enne selle ühendamist suure hulga vesinikuaatomitega.
Markovnikov sõnastas selle reegli katseandmete põhjal ja alles palju hiljem sai see teoreetilise põhjenduse. Mõelge propüleeni reaktsioonile vesinikkloriidiga.
$p$ sideme üks omadusi on selle võime kergesti polariseerida. Metüülrühma (positiivne induktiivne efekt + $I$) mõjul propeeni molekulis nihkub $p$ sideme elektrontihedus ühele süsinikuaatomitest (= $CH_2$). Selle tulemusena ilmub sellele osaline negatiivne laeng ($\delta -$). Kaksiksideme teisele süsinikuaatomile ilmub osaline positiivne laeng ($\delta +$).
Selline elektrontiheduse jaotus propüleeni molekulis määrab tulevase prootonirünnaku asukoha. See on metüleenrühma süsinikuaatom (= $CH_2$), mis kannab osalist negatiivset $\delta-$ laengut. Ja kloor ründab vastavalt süsinikuaatomit osalise positiivse laenguga $\delta+$.
Selle tulemusena on propüleeni ja vesinikkloriidi reaktsiooni põhiproduktiks 2-kloropropaan.
Niisutus
Alkeenide hüdratsioon toimub mineraalhapete juuresolekul ja järgib Markovnikovi reeglit. Reaktsiooniproduktid on alkoholid
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Alküleerimine
Alkaanide lisamine alkeenidele happekatalüsaatori ($HF$ või $H_2SO_4$) juuresolekul madalatel temperatuuridel põhjustab suurema molekulmassiga süsivesinike moodustumist ja seda kasutatakse sageli tööstuses mootorikütuse tootmiseks.
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Oksüdatsioonireaktsioonid
Sõltuvalt oksüdeerivate reaktiivide tingimustest ja tüüpidest võib alkeenide oksüdeerumine toimuda nii kaksiksideme lõhustamisega kui ka süsinikskeleti säilimisega:
Polümerisatsioonireaktsioonid
Alkeenmolekulid on teatud tingimustel võimelised üksteisele lisanduma $\pi$ sidemete avanemise ja dimeeride, trimmerite või suure molekulmassiga ühendite - polümeeride moodustumisega. Alkeenide polümerisatsioon võib toimuda kas vabade radikaalide või katioon-anioonmehhanismi abil. Polümerisatsiooni initsiaatoritena kasutatakse happeid, peroksiide, metalle jne. Polümerisatsioonireaktsioon toimub ka temperatuuri, kiiritamise ja rõhu mõjul. Tüüpiline näide on etüleeni polümerisatsioon polüetüleeni moodustamiseks
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
Asendusreaktsioonid
Asendusreaktsioonid ei ole alkeenidele tüüpilised. Kuid kõrgel temperatuuril (üle 400 ° C) pärsitakse radikaalide liitumisreaktsioone, mis on pöörduvad. Sel juhul on võimalik asendada allüülasendis asuv vesinikuaatom, säilitades samas kaksiksideme
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Orgaanilises keemias võib leida süsivesinikaineid, mille ahelas on erinev kogus süsinikku ja C=C side. Need on homoloogid ja neid nimetatakse alkeenideks. Oma struktuuri tõttu on nad keemiliselt reaktsioonivõimelisemad kui alkaanid. Kuid millised reaktsioonid on neile tüüpilised? Vaatleme nende levikut looduses, erinevaid tootmis- ja kasutusviise.
Mis need on?
Alkeenid, mida nimetatakse ka olefiinideks (õlisteks), on saanud oma nime eteenkloriidi järgi, mis on selle rühma esimese liikme derivaat. Kõigil alkeenidel on vähemalt üks C=C kaksikside. C n H 2n on kõigi olefiinide valem ja nimi on moodustatud alkaanist, mille molekulis on sama arv süsinikke, ainult järelliide -ane muutub -eeniks. Sidekriipsuga eraldatud araabia number nime lõpus näitab süsiniku arvu, millest kaksikside algab. Vaatame peamisi alkeene, tabel aitab teil neid meeles pidada:
Kui molekulid on lihtsa, hargnemata struktuuriga, siis lisatakse järelliide -üleen, see kajastub ka tabelis.
Kust neid leida?
Kuna alkeenide reaktsioonivõime on väga kõrge, on nende esindajad looduses äärmiselt haruldased. Olefiini molekuli elupõhimõte on "olgem sõbrad". Muid aineid ümberringi pole – pole probleemi, me oleme üksteisega sõbrad, moodustades polümeere.
Kuid need on olemas ja väike arv esindajaid sisaldub kaasnevas naftagaasis ja suuremad on Kanadas toodetud naftas.
Alkeenide kõige esimene esindaja, eteen, on hormoon, mis stimuleerib puuviljade valmimist, seetõttu sünteesivad seda väikestes kogustes taimestiku esindajad. Seal on alkeen, cis-9-trikooseen, mis mängib emaste kodukärbeste puhul seksuaalse atraktandi rolli. Seda nimetatakse ka muskaluriks. (Atraktant on loodusliku või sünteetilise päritoluga aine, mis tekitab tõmmet teises organismis lõhnaallika poole). Keemilisest seisukohast näeb see alkeen välja järgmine:
Kuna kõik alkeenid on väga väärtuslikud toorained, on nende kunstliku tootmise meetodid väga mitmekesised. Vaatame kõige levinumaid.
Mis siis, kui vajate palju?
Tööstuses saadakse alkeenide klass peamiselt krakkimise teel, s.o. molekuli lõhustumine kõrgete temperatuuride, kõrgemate alkaanide mõjul. Reaktsioon nõuab kuumutamist vahemikus 400 kuni 700 °C. Alkaan jaguneb soovitud viisil, moodustades alkeene, mille saamise meetodeid me kaalume, ja millel on suur hulk molekulaarstruktuuri valikuid:
C7H16 -> CH3-CH=CH2 + C4H10.
Teist levinud meetodit nimetatakse dehüdrogeenimiseks, mille käigus vesiniku molekul eraldatakse alkaani seeria esindajast katalüsaatori juuresolekul.
Laboritingimustes erinevad alkeenid ja valmistamismeetodid, need põhinevad eliminatsioonireaktsioonidel (aatomirühma elimineerimine ilma nende asendamiseta). Kõige sagedamini alkoholidest eemaldatud veeaatomid on halogeenid, vesinik või vesinikhalogeniidid. Kõige tavalisem viis alkeenide saamiseks on alkoholidest happe kui katalüsaatori juuresolekul. Võimalik on kasutada ka teisi katalüsaatoreid
Kõik eliminatsioonireaktsioonid alluvad Zaitsevi reeglile, mis ütleb:
Vesinikuaatom eraldub süsinikust, mis külgneb vähem vesinikke sisaldava süsinikuga, mis kannab rühma -OH.

Pärast reegli rakendamist vastake, milline reaktsioonisaadus domineerib? Hiljem saad teada, kas vastasid õigesti.
Keemilised omadused
Alkeenid reageerivad aktiivselt ainetega, katkestades nende pi-sideme (teine nimi C=C-sidemele). Lõppude lõpuks pole see nii tugev kui üksikside (sigma side). Süsivesinik muundatakse küllastumata küllastunudks, ilma et pärast reaktsiooni (lisamist) tekiks muid aineid.
- vesiniku lisamine (hüdrogeenimine). Selle läbimiseks on vajalik katalüsaatori olemasolu ja kuumutamine;
- halogeeni molekulide lisamine (halogeenimine). See on üks kvalitatiivsetest reaktsioonidest pi-sidemele. Lõppude lõpuks, kui alkeenid reageerivad broomiveega, muutub see pruunist läbipaistvaks;
- reaktsioon vesinikhalogeniididega (hüdrohalogeenimine);
- vee lisamine (hüdratsioon). Reaktsiooni toimumise tingimused on kuumutamine ja katalüsaatori (happe) olemasolu;
Asümmeetriliste olefiinide reaktsioonid vesinikhalogeniidide ja veega järgivad Markovnikovi reeglit. See tähendab, et vesinik seob end süsinik-süsinik kaksiksideme süsinikuga, millel on juba rohkem vesinikuaatomeid.

- põlemine;
- mittetäielik oksüdatsiooni katalüütik. Toode on tsüklilised oksiidid;
- Wagneri reaktsioon (oksüdatsioon permanganaadiga neutraalses keskkonnas). See alkeeni reaktsioon on veel üks kvalitatiivne C=C side. Voolu käigus muutub roosa kaaliumpermanganaadi lahus värvituks. Kui sama reaktsioon viiakse läbi kombineeritud happelises keskkonnas, on tooted erinevad (karboksüülhapped, ketoonid, süsinikdioksiid);
- isomerisatsioon. Iseloomulikud on kõik tüübid: cis- ja trans-, kaksiksideme liikumine, tsüklistumine, skeleti isomerisatsioon;
- Polümerisatsioon on olefiinide peamine omadus tööstuses.
Rakendus meditsiinis
Alkeenide reaktsiooniproduktidel on suur praktiline tähtsus. Paljusid neist kasutatakse meditsiinis. Glütseriin saadakse propeenist. See mitmehüdroksüülne alkohol on suurepärane lahusti ja kui seda kasutatakse vee asemel, on lahused kontsentreeritumad. Meditsiinilistel eesmärkidel lahustatakse selles alkaloide, tümooli, joodi, broomi jm.Glütseriini kasutatakse ka salvide, pastade ja kreemide valmistamisel. See hoiab ära nende kuivamise. Glütseriin ise on antiseptik.
Vesinikkloriidiga reageerimisel saadakse derivaadid, mida kasutatakse nahale kandmisel kohaliku tuimestusena, samuti lühiajaliseks anesteesiaks väiksemate kirurgiliste sekkumiste ajal, kasutades sissehingamist.

Alkadieenid on alkeenid, mille ühes molekulis on kaks kaksiksidet. Nende põhiliseks kasutusalaks on sünteetilise kummi tootmine, millest valmistatakse siis erinevaid soojenduspatju ja süstlaid, sonde ja kateetreid, kindaid, lutte ja palju muud, mis on haigete hooldamisel lihtsalt asendamatud.
Tööstuslikud rakendused
| Tööstuse tüüp | Mida kasutatakse | Kuidas nad saavad kasutada |
| Põllumajandus | eteen | kiirendab köögiviljade ja puuviljade valmimist, taimede defoliatsiooni, kasvuhoonete kilesid |
| Lakk ja värviline | eteen, buteen, propeen jne. | lahustite, eetrite, lahustite tootmiseks |
| Masinaehitus | 2-metüülpropeen, eteen | sünteetilise kummi, määrdeõlide, antifriisi tootmine |
| Toidutööstus | eteen | tefloni, etüülalkoholi, äädikhappe tootmine |
| Keemiatööstus | eteen, polüpropüleen | saadakse alkoholid, polümeerid (polüvinüülkloriid, polüetüleen, polüvinüülatsetaat, polüisobtüleen, atsetaldehüüd) |
| Kaevandamine | eteen jne. | lõhkeained |
Alkeenid ja nende derivaadid on leidnud tööstuses laiemat kasutust. (Kus ja kuidas alkeene kasutatakse, ülaltoodud tabel).

See on vaid väike osa alkeenide ja nende derivaatide kasutamisest. Iga aastaga nõudlus olefiinide järele ainult kasvab, mis tähendab, et suureneb ka vajadus nende tootmise järele.