Teadmiste hüpermarket >> Keemia >> Keemia 10. klass >> Keemia: alkeenid
Küllastumata hulka kuuluvad süsivesinikud, mis sisaldavad oma molekulides mitut sidet süsinikuaatomite vahel. Küllastumata on alkeenid, alküünid, alkadieenid (polüeenid). Küllastumata on ka tsüklilised süsivesinikud, mis sisaldavad tsüklis kaksiksidet (tsükloalkeenid), aga ka väikese arvu süsinikuaatomitega tsüklis (kolm või neli aatomit) tsükloalkaanid. "Küllastumatuse" omadus on seotud nende ainete võimega astuda liitumisreaktsioonidesse, peamiselt vesiniku, küllastunud või küllastunud süsivesinike - alkaanide moodustumisega.
Struktuur
Alkeenid on atsüklilised, sisaldades molekulis lisaks üksiksidemetele üht kaksiksidet süsinikuaatomite vahel ja vastavad üldvalemile C n H 2n.
Alkeenid said oma teise nime - "olefiinid" analoogselt küllastumata rasvhapetega (oleiin-, linoolhape), mille jäänused on osa vedelast rasvast - õlidest (inglise keelest õli - õli).
Süsinikuaatomid, mille vahel on kaksikside, nagu teate, on sp 2 hübridisatsiooni olekus. See tähendab, et hübridisatsioonis osalevad üks s- ja kaks p-orbitaali ning üks p-orbitaal jääb hübridiseerimata. Hübriidorbitaalide kattumine viib a-sideme tekkeni ja etüleeni molekuli naabersüsinikuaatomite hübridiseerimata -orbitaalide tõttu tekib teine, P-ühendus. Seega koosneb kaksikside ühest Þ-sidemest ja ühest p-sidemest.
Kaksiksidet moodustavate aatomite hübriidorbitaalid on samas tasapinnas ning n-sideme moodustavad orbitaalid asetsevad risti molekuli tasandiga (vt joonis 5).
Kaksikside (0,132 nm) on lühem kui üksikside ja selle energia on suurem, st tugevam. Sellegipoolest viib liikuva, kergesti polariseeruva 7g-sideme olemasolu selleni, et alkeenid on keemiliselt aktiivsemad kui alkaanid ja on võimelised läbima liitumisreaktsioone.
Eteeni homoloogne seeria
Sirge ahelaga alkeenid moodustavad eteeni (etüleeni) homoloogse seeria.
C2H4 - eteen, C3H6 - propeen, C4H8 - buteen, C5H10 - penteen, C6H12 - hekseen jne.
Isomerism ja nomenklatuur
Alkeene, nagu alkaanegi, iseloomustab struktuurne isomeeria. Nagu mäletate, erinevad struktuursed isomeerid üksteisest süsiniku skeleti struktuuri poolest. Lihtsaim alkeen, mida iseloomustavad struktuursed isomeerid, on buteen.
CH3-CH2-CH=CH2CH3-C=CH2
l
CH3
buteen-1 metüülpropeen
Struktuurse isomeeria eritüüp on kaksiksideme positsiooni isomeeria:
CH3-CH2-CH=CH2CH3-CH=CH-CH3
buteen-1 buteen-2
Süsinikuaatomite peaaegu vaba pöörlemine on võimalik ühe süsinik-süsinik sideme ümber, nii et alkaani molekulid võivad võtta väga erinevaid kujundeid. Pöörlemine ümber kaksiksideme on võimatu, mis põhjustab alkeenides teist tüüpi isomeeride ilmnemist - geomeetrilist või cis-trans isomeeria.
Cis-isomeerid erinevad rindkere isomeeridest molekulaarsete fragmentide (antud juhul metüülrühmade) ruumilise paigutuse poolest tasapinna suhtes P-ühendused ja seega ka omadused.
Alkeenid on tsükloalkaanide suhtes isomeersed (klassidevaheline isomeeria), näiteks:
CH2 = CH-CH2-CH2-CH2-CH3
hekseen-1 tsükloheksaan
Nomenklatuur alkeenid, mille on välja töötanud IUPAC, on sarnane alkaanide nomenklatuuriga.
1. Põhiahela valik
Süsivesiniku nime kujunemine algab peaahela – molekuli pikima süsinikuaatomite ahela – määratlemisest. Alkeenide puhul peab põhiahel sisaldama kaksiksidet.
2. Peaahela aatomite nummerdamine
Peaahela aatomite nummerdamine algab otsast, millele kaksikside on kõige lähemal. Näiteks õige ühenduse nimi on
dn3-dn-dn2-dn=dn-dn3 dn3
5-metüülhekseen-2, mitte 2-metüülhekseen-4, nagu võiks eeldada.
Kui kaksiksideme asend ei suuda määrata aatomite numeratsiooni algust ahelas, siis määratakse see asendajate asukoha järgi samamoodi nagu küllastunud süsivesinike puhul.
CH3-CH2-CH=CH-CH-CH3
l
CH3
2-metüülhekseen-3
3. Nime kujunemine
Alkeenide nimed moodustatakse samamoodi nagu alkaanide nimed. Nime lõppu märkige süsinikuaatomi number, millest kaksikside algab, ja järelliide, mis näitab, et ühend kuulub alkeenide klassi -een.
Kviitung
1. Naftasaaduste krakkimine. Küllastunud süsivesinike termilise krakkimise protsessis koos alkaanide moodustumisega tekivad alkeenid.
2. Küllastunud süsivesinike dehüdrogeenimine. Kui alkaanid juhitakse üle katalüsaatori kõrgel temperatuuril (400-600 °C), elimineeritakse vesiniku molekul ja moodustub alkeen: 
3. Alkoholide dehüdratsioon (vee eemaldamine). Vett eemaldavate ainete (H2804, Al203) toime ühehüdroksüülsetele alkoholidele kõrgel temperatuuril viib veemolekuli elimineerimiseni ja kaksiksideme moodustumiseni:
Seda reaktsiooni nimetatakse intramolekulaarseks dehüdratsiooniks (erinevalt molekulidevahelisest dehüdratsioonist, mis viib eetrite moodustumiseni ja mida uuritakse paragrahvis 16 “Alkoholid”).
4. Dehüdrohalogeenimine (vesinikhalogeniidi elimineerimine).
Kui haloalkaan reageerib alkoholilahuses leelisega, tekib vesinikhalogeniidi molekuli elimineerimise tulemusena kaksikside.
Pange tähele, et see reaktsioon tekitab peamiselt buteen-2, mitte buteen-1, mis vastab Zaitsevi reegel:
Kui vesinikhalogeniid elimineeritakse sekundaarsetest ja tertsiaarsetest haloalkaanidest, elimineeritakse vesinikuaatom kõige vähem hüdrogeenitud süsinikuaatomist.
5. Dehalogeenimine. Kui tsink toimib alkaani dibromoderivaadile, elimineeritakse naabersüsinikuaatomite juures asuvad halogeeniaatomid ja moodustub kaksikside: 
Füüsikalised omadused
Alkeenide homoloogse seeria kolm esimest esindajat on gaasid, ained koostisega C5H10-C16H32 on vedelikud ja kõrgemad alkeenid on tahked ained.
Keemis- ja sulamistemperatuurid tõusevad loomulikult koos ühendite molekulmassi suurenemisega.
Keemilised omadused
Lisamisreaktsioonid
Tuletagem meelde, et küllastumata süsivesinike - alkeenide - esindajate eripäraks on võime osaleda liitumisreaktsioonides. Enamik neist reaktsioonidest kulgeb elektrofiilse liitmismehhanismi abil.
1. Alkeenide hüdrogeenimine. Alkeenid on võimelised lisama vesinikku hüdrogeenimiskatalüsaatorite juuresolekul - metallid - plaatina, pallaadium, nikkel:
CH3-CH2-CH=CH2 + H2 -> CH3-CH2-CH2-CH3
See reaktsioon toimub nii atmosfäärirõhul kui ka kõrgendatud rõhul ega vaja kõrget temperatuuri, kuna see on eksotermiline. Kui temperatuur tõuseb, võivad samad katalüsaatorid põhjustada pöördreaktsiooni – dehüdrogeenimist.
2. Halogeenimine (halogeenide lisamine). Alkeeni interaktsioon broomveega või broomi lahusega orgaanilises lahustis (CCl4) põhjustab nende lahuste kiiret värvimuutust, mis on tingitud halogeeni molekuli lisamisest alkeenile ja dihaloalkaanide moodustumisest.
Markovnikov Vladimir Vassiljevitš
(1837-1904)
Vene orgaaniline keemik. Formuleeritud (1869) reeglid asendamise, eliminatsiooni, kaksiksideme juures lisamise ja isomeerimisreaktsioonide suuna kohta sõltuvalt keemilisest struktuurist. Ta uuris (alates 1880. aastast) nafta koostist ja pani aluse naftakeemiale kui iseseisvale teadusele. Avastas (1883) uue orgaaniliste ainete klassi – tsükloparafiinid (nafteenid).
3. Hüdrohalogeenimine (vesinikhalogeniidi lisamine).
Vesinikhalogeniidi liitumisreaktsiooni käsitletakse üksikasjalikumalt allpool. See reaktsioon järgib Markovnikovi reeglit:
Kui vesinikhalogeniid seostub alkeeniga, kinnitub vesinik rohkem hüdrogeenitud süsinikuaatomiga, st aatomiga, millel on rohkem vesinikuaatomeid, ja halogeen vähem hüdrogeenitud süsinikuaatomiga.
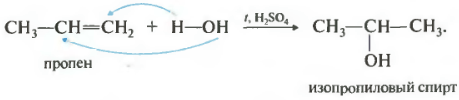
4. Niisutamine (vee lisamine). Alkeenide hüdratsioon põhjustab alkoholide moodustumist. Näiteks vee lisamine eteenile on ühe etüülalkoholi tootmise tööstusliku meetodi aluseks:
CH2=CH2 + H2O -> CH3-CH2OH
eteen etanool
Pange tähele, et primaarne alkohol (mille primaarsel süsinikul on hüdroksürühm) moodustub ainult siis, kui eteen on hüdraatunud. Propeeni või teiste alkeenide hüdraatumisel tekivad sekundaarsed alkoholid. 
Ka see reaktsioon kulgeb Markovnikovi reegli kohaselt – vesinikkatioon kinnitub rohkem hüdrogeenitud süsinikuaatomiga ja hüdroksürühm vähem hüdrogeenitud aatomiga.
5. Polümerisatsioon. Lisamise erijuhtum on alkeenide polümerisatsioonireaktsioon:
See liitumisreaktsioon toimub vabade radikaalide mehhanismi kaudu.
Oksüdatsioonireaktsioonid
Nagu kõik orgaanilised ühendid, põlevad alkeenid hapnikus, moodustades CO2 ja H20.
Erinevalt alkaanidest, mis on lahustes oksüdeerumisele vastupidavad, oksüdeeruvad alkeenid kergesti kaaliumpermanganaadi vesilahuste toimel. Neutraalsetes või kergelt leeliselistes lahustes oksüdeeritakse alkeenid dioolideks (dihüdroksüülsed alkoholid) ja hüdroksüülrühmad lisatakse nendele aatomitele, mille vahel eksisteeris enne oksüdatsiooni kaksikside.
Nagu te juba teate, on küllastumata süsivesinikud - alkeenid võimelised osalema liitumisreaktsioonides. Enamik neist reaktsioonidest kulgeb elektrofiilse liitmismehhanismi abil.
Elektrofiilne ühendus
Elektrofiilsed reaktsioonid on reaktsioonid, mis toimuvad elektrofiilide - osakeste, millel puudub elektrontihedus, näiteks täitmata orbitaal, mõjul. Lihtsaim elektrofiilne osake on vesiniku katioon. On teada, et vesinikuaatomil on 3. orbitaalil üks elektron. Vesiniku katioon tekib siis, kui aatom kaotab selle elektroni, seega pole vesiniku katioonil üldse elektrone:
Н· - 1е - -> Н +
Sel juhul on katioonil üsna kõrge elektronafiinsus. Nende tegurite kombinatsioon muudab vesiniku katioonist üsna tugeva elektrofiilse osakese.
Vesinikkatiooni moodustumine on võimalik hapete elektrolüütilise dissotsiatsiooni käigus:
НВr -> Н + + Вr -
Just sel põhjusel toimuvad hapete juuresolekul ja osalusel paljud elektrofiilsed reaktsioonid.
Nagu varem mainitud, toimivad elektrofiilsed osakesed süsteemidele, mis sisaldavad suurenenud elektrontihedusega piirkondi. Sellise süsteemi näide on mitmekordne (kaksik- või kolmik) süsinik-süsinik side.
Te juba teate, et süsinikuaatomid, mille vahel moodustub kaksikside, on sp 2 hübridisatsiooni olekus. Samal tasapinnal paiknevate naabersüsinikuaatomite hübridiseerimata p-orbitaalid kattuvad, moodustuvad P-side, mis on vähem tugev kui Þ-side ja mis kõige tähtsam, polariseerub kergesti välise elektrivälja mõjul. See tähendab, et positiivselt laetud osakese lähenemisel nihkuvad CS-sideme elektronid selle poole ja nn. P- keeruline.
Selgub P-kompleks ja vesinikkatiooni lisamisel P- ühendused. Näib, et vesiniku katioon põrkub molekuli tasapinnast väljaulatuvasse elektrontihedusse P-ühendus ja sellega liitumine. ![]()
Järgmises etapis toimub elektronipaari täielik nihkumine P-sideme ühe süsinikuaatomiga, mis viib selle üksiku elektronpaari ilmumiseni. Süsinikuaatomi orbitaal, millel see paar asub, ja vesinikkatiooni hõivamata orbitaal kattuvad, mis viib kovalentse sideme moodustumiseni doonor-aktseptormehhanismi kaudu. Teisel süsinikuaatomil on endiselt täitmata orbitaal, st positiivne laeng.
Saadud osakest nimetatakse karbokatiooniks, kuna see sisaldab süsinikuaatomi positiivset laengut. See osake võib ühineda mis tahes aniooniga, osakesega, millel on üksik elektronpaar, st nukleofiil.
Vaatleme elektrofiilse liitumisreaktsiooni mehhanismi, kasutades eteeni hüdrobroomimise (vesinikbromiidi lisamise) näidet:
СН2= СН2 + НВг --> СНВr-СН3
Reaktsioon algab elektrofiilse osakese – vesinikkatiooni moodustumisega, mis tekib vesinikbromiidi molekuli dissotsiatsiooni tulemusena.
Vesinikkatioonide rünnakud P- ühendamine, moodustamine P- kompleks, mis muundatakse kiiresti karbokatiooniks: 
Vaatame nüüd keerulisemat juhtumit.
Vesinikbromiidi eteenile lisamise reaktsioon kulgeb ühemõtteliselt ning vesinikbromiidi ja propeeni koostoime võib teoreetiliselt anda kaks produkti: 1-bromopropaan ja 2-bromopropaan. Eksperimentaalsed andmed näitavad, et peamiselt toodetakse 2-bromopropaani.
Selle selgitamiseks peame arvestama vaheosakesega - karbokatatsiooniga.
Vesiniku katiooni lisamine propeenile võib viia kahe karbokatiooni moodustumiseni: kui vesiniku katioon liitub esimese süsinikuaatomiga, ahela lõpus asuva aatomiga, siis teine on positiivse laenguga, s.t. molekuli kese (1); kui see liitub teisega, siis on esimesel aatomil positiivne laeng (2). 
Reaktsiooni eelistatud suund sõltub sellest, millist karbokatiooni on reaktsioonikeskkonnas rohkem, mille omakorda määrab karbokatiooni stabiilsus. Katse näitab valdavat 2-bromopropaani moodustumist. See tähendab, et suuremal määral tekib keskaatomil positiivse laenguga karbokatioon (1).
Selle karbokatiooni suurem stabiilsus on seletatav asjaoluga, et keskse süsinikuaatomi positiivset laengut kompenseerib kahe metüülrühma positiivne induktiivne toime, mille kogumõju on suurem kui ühe etüülrühma +/- mõju:
Alkeenide hüdrohalogeenimise reaktsioonide seadusi uuris kuulus vene keemik V. V. Markovnikov, A. M. Butlerovi õpilane, kes, nagu eespool mainitud, sõnastas oma nime kandva reegli.
See reegel kehtestati empiiriliselt, st eksperimentaalselt. Praegu saame sellele anda täiesti veenva seletuse.
Huvitaval kombel järgivad Markovnikovi reeglit ka teised elektrofiilsed liitmisreaktsioonid, mistõttu oleks õige sõnastada see üldisemal kujul.
Elektrofiilsetes liitumisreaktsioonides lisandub elektrofiil (täitmata orbitaaliga osake) rohkem hüdrogeenitud süsinikuaatomile ja nukleofiil (üksiku elektronide paariga osake) vähem hüdrogeenitud süsinikuaatomile.
Polümerisatsioon
Liitmisreaktsiooni erijuht on alkeenide ja nende derivaatide polümerisatsioonireaktsioon. See reaktsioon toimub vabade radikaalide lisamise mehhanismi kaudu:
Polümerisatsioon viiakse läbi initsiaatorite - peroksiidühendite juuresolekul, mis on vabade radikaalide allikas. Peroksiidühendid on ained, mille molekulid sisaldavad -O-O- rühma. Lihtsaim peroksiidiühend on vesinikperoksiid HOOH.
Temperatuuril 100 °C ja rõhul 100 MPa toimub ebastabiilse hapniku-hapniku sideme homolüüs ja radikaalide - polümerisatsiooni initsiaatorite - moodustumine. KO-radikaalide mõjul käivitatakse polümerisatsioon, mis areneb vabade radikaalide liitumisreaktsioonina. Ahela kasv peatub, kui reaktsioonisegus toimub radikaalide rekombinatsioon - polümeeri ahel ja radikaalid ehk COCH2CH2-.
Kaksiksidet sisaldavate ainete vabade radikaalide polümerisatsiooni reaktsiooni abil saadakse suur hulk suure molekulmassiga ühendeid: 
Erinevate asendajatega alkeenide kasutamine võimaldab sünteesida laia valikut polümeerseid materjale, millel on lai valik omadusi. 
Kõiki neid polümeerseid ühendeid kasutatakse laialdaselt erinevates inimtegevuse valdkondades – tööstuses, meditsiinis, kasutatakse biokeemiliste laborite seadmete valmistamiseks, mõned on vaheühendid teiste kõrgmolekulaarsete ühendite sünteesiks.
Oksüdatsioon
Te juba teate, et neutraalsetes või kergelt leeliselistes lahustes toimub alkeenide oksüdatsioon dioolideks (dihüdroksüülsete alkoholide). Happelises keskkonnas (väävelhappega hapestatud lahus) kaksikside hävib täielikult ja süsinikuaatomid, mille vahel kaksikside eksisteeris, muundatakse karboksüülrühma süsinikuaatomiteks: 
Alkeenide destruktiivset oksüdatsiooni saab kasutada nende struktuuri määramiseks. Näiteks kui teatud alkeeni oksüdeerimisel saadakse äädik- ja propioonhapped, tähendab see, et penteen-2 on oksüdeerunud ja kui saadakse võihape ja süsinikdioksiid, on algne süsivesinik penteen-1. .
Rakendus
Alkeene kasutatakse keemiatööstuses laialdaselt toorainena mitmesuguste orgaaniliste ainete ja materjalide tootmiseks.
Näiteks eteen on etanooli, etüleenglükooli, epoksiidide ja dikloroetaani tootmise lähteaine.
Suur hulk eteeni töödeldakse polüetüleeniks, millest valmistatakse pakkekile, lauanõusid, torusid ja elektriisolatsioonimaterjale.
Glütseriin, atsetoon, isopropanool ja lahustid saadakse propeenist. Propeeni polümeriseerimisel saadakse polüpropüleen, mis on mitmes mõttes parem kui polüetüleen: sellel on kõrgem sulamistemperatuur ja keemiline vastupidavus.
Praegu toodetakse ainulaadsete omadustega kiude polümeeridest - polüetüleeni analoogidest. Näiteks polüpropüleenkiud on tugevam kui kõik teadaolevad sünteetilised kiud.
Nendest kiududest valmistatud materjalid on paljulubavad ja neid kasutatakse üha enam erinevates inimtegevuse valdkondades.

1. Mis tüüpi isomeeria on alkeenidele iseloomulik? Kirjutage penteen-1 võimalike isomeeride valemid.
2. Millistest ühenditest saab: a) isobuteen (2-metüülpropeen); b) buteen-2; c) buteen-1? Kirjutage vastavate reaktsioonide võrrandid.
3. Dešifreerige järgmine teisenduste ahel. Nimetage ühendid A, B, C. 4. Pakkuge välja meetod 2-kloropropaani saamiseks 1-kloropropaanist. Kirjutage vastavate reaktsioonide võrrandid.
5. Soovitage meetod etaani puhastamiseks etüleeni lisanditest. Kirjutage vastavate reaktsioonide võrrandid.
6. Tooge näiteid reaktsioonidest, mille abil saab eristada küllastunud ja küllastumata süsivesinikke.
7. 2,8 g alkeeni täielikuks hüdrogeenimiseks kulutati 0,896 liitrit vesinikku (n.e.). Mis on selle normaalse süsinikuaatomiahelaga ühendi molekulmass ja struktuurivalem?
8. Mis gaas on silindris (eteen või propeen), kui on teada, et 20 cm3 selle gaasi täielikuks põlemiseks kulus 90 cm3 (n.s.) hapnikku?
9*. Kui alkeen reageerib pimedas klooriga, tekib 25,4 g dikloriidi ja kui see sama massiga alkeen reageerib broomiga süsiniktetrakloriidis, siis 43,2 g dibromiidi. Määrake lähtealkeeni kõik võimalikud struktuurivalemid.
Avastamise ajalugu
Ülaltoodud materjalist oleme juba aru saanud, et etüleen on küllastumata süsivesinike homoloogse seeria esivanem, millel on üks kaksikside. Nende valem on C n H 2n ja neid nimetatakse alkeenideks.
1669. aastal sai saksa arst ja keemik Becher esimesena etüleeni väävelhappe reageerimisel etüülalkoholiga. Becher leidis, et etüleen on keemiliselt aktiivsem kui metaan. Kuid kahjuks ei suutnud teadlane sel ajal tekkinud gaasi tuvastada ega andnud seetõttu sellele nime.
Veidi hiljem kasutasid Hollandi keemikud etüleeni tootmiseks sama meetodit. Ja kuna see kippus klooriga suhtlemisel moodustama õlist vedelikku, sai see vastavalt nimetuse "naftagaas". Hiljem sai teatavaks, et see vedelik oli dikloroetaan.
Prantsuse keeles on mõiste "õli" oléfiant. Ja pärast teiste seda tüüpi süsivesinike avastamist võttis prantsuse keemik ja teadlane Antoine Fourcroix kasutusele uue termini, mis sai tavaliseks kogu olefiinide või alkeenide klassi jaoks.
Kuid juba 19. sajandi alguses avastas prantsuse keemik J. Gay-Lussac, et etanool ei koosne mitte ainult naftagaasist, vaid ka veest. Lisaks avastati sama gaas etüülkloriidis.
Ja kuigi keemikud tegid kindlaks, et etüleen koosneb vesinikust ja süsinikust, ning teadsid juba ainete koostist, ei suutnud nad pikka aega selle tegelikku valemit leida. Ja alles 1862. aastal õnnestus E. Erlenmeyeril tõestada kaksiksideme olemasolu etüleeni molekulis. Seda tunnistas ka vene teadlane A. M. Butlerov ja kinnitas selle vaatenurga õigsust eksperimentaalselt.
Alkeenide esinemine looduses ja füsioloogiline roll
Paljud inimesed on huvitatud küsimusest, kus alkeene looduses leidub. Niisiis selgub, et looduses neid praktiliselt ei esine, kuna selle lihtsaim esindaja etüleen on taimede hormoon ja seda sünteesitakse neis ainult väikestes kogustes.
Tõsi, looduses leidub selline alkeen nagu muskalur. See üks looduslikest alkeenidest on emase kodukärbse seksuaalne atraktant.
Tasub pöörata tähelepanu asjaolule, et kõrge kontsentratsiooniga madalamatel alkeenidel on narkootiline toime, mis võib põhjustada krampe ja limaskestade ärritust.
Alkeenide rakendused
Tänapäeva kaasaegse ühiskonna elu on raske ette kujutada ilma polümeermaterjalide kasutamiseta. Kuna erinevalt looduslikest materjalidest on polümeeridel erinevad omadused, on neid lihtne töödelda ja kui hinda vaadata, siis on need suhteliselt odavad. Teine oluline aspekt polümeeride kasuks on see, et paljusid neist saab taaskasutada.
Alkeene on kasutatud plastide, kummide, kilede, tefloni, etüülalkoholi, atseetaldehüüdi ja muude orgaaniliste ühendite tootmisel.

Põllumajanduses kasutatakse seda vahendina, mis kiirendab puuviljade valmimisprotsessi. Propüleeni ja butüleene kasutatakse erinevate polümeeride ja alkoholide tootmiseks. Kuid sünteetilise kummi tootmisel kasutatakse isobutüleeni. Seetõttu võime järeldada, et ilma alkeenideta ei saa hakkama, kuna need on kõige olulisemad keemilised toorained.
Etüleeni tööstuslik kasutamine
Tööstuslikus mastaabis kasutatakse propüleeni tavaliselt polüpropüleeni sünteesiks ning isopropanooli, glütserooli, butüüraldehüüdide jms tootmiseks. Igal aastal suureneb nõudlus propüleeni järele.

Alkeenid (olefiinid, etüleeni süsivesinikud C n H 2n
Homoloogne seeria.
|
eteen (etüleen) | |
Lihtsaim alkeen on etüleen (C 2 H 4). IUPAC-i nomenklatuuri järgi moodustatakse alkeenide nimetused vastavate alkaanide nimedest, asendades järelliide “-ane” “-ene”-ga; Kaksiksideme asukoht on tähistatud araabia numbriga.
Alkeenidest moodustunud süsivesinikradikaalidel on järelliide "-enil". Triviaalsed nimed: CH 2 =CH- "vinüül", CH 2 =CH-CH 2 - "allüül".
Kaksiksideme süsinikuaatomid on sp2 hübridisatsiooni olekus ja nende sideme nurk on 120°.
Alkeene iseloomustab süsiniku skeleti isomeeria, kaksiksideme positsioonid, klassidevaheline ja ruumiline.
Füüsikalised omadused
Alkeenide sulamis- ja keemistemperatuurid (lihtsustatud) suurenevad koos molekulmassi ja süsiniku karkassi pikkusega.
Normaaltingimustes on C 2 H 4 kuni C 4 H 8 alkeenid gaasid; penteenist C 5 H 10 kuni heksadetseeni C 17 H 34 (kaasa arvatud) - vedelikud ja alates oktadetseenist C 18 H 36 - tahked ained. Alkeenid ei lahustu vees, kuid lahustuvad hästi orgaanilistes lahustites.
Alkaanide dehüdrogeenimine
See on üks tööstuslikke meetodeid alkeenide tootmiseks
Alküünide hüdrogeenimine
Alküünide osaline hüdrogeenimine nõuab eritingimusi ja katalüsaatori olemasolu
Kaksikside on sigma- ja pi-sidemete kombinatsioon. Sigma side tekib siis, kui sp2 orbitaalid kattuvad aksiaalselt, ja pi side tekib külgmise kattumise korral.
Zaitsevi reegel:
Vesiniku aatomi eemaldamine eliminatsioonireaktsioonides toimub valdavalt kõige vähem hüdrogeenitud süsinikuaatomist.
13. Alkeenid. Struktuur. sp 2 hübridisatsioon, mitu sidumisparameetrit. Halogeenide, vesinikhalogeniidide, hüpokloorhappe elektrofiilse lisamise reaktsioonid. Alkeenide hüdratsioon. Morkovnikovi valitsemine. Reaktsioonide mehhanismid.
Alkeenid (olefiinid, etüleeni süsivesinikud) - atsüklilised küllastumata süsivesinikud, mis sisaldavad ühte kaksiksidet süsinikuaatomite vahel, moodustades homoloogse rea üldvalemiga C n H 2n
Üks s- ja 2 p-orbitaali segunevad ja moodustavad 2 ekvivalentset sp2-hübriidorbitaali, mis asuvad samal tasapinnal 120 nurga all.
Kui sideme moodustab rohkem kui üks elektronide paar, siis seda nimetatakse mitmekordne.
Mitmikside tekib siis, kui keskaatomi iga sidet moodustava valentsorbitaali jaoks on liiga vähe elektrone ja sideaatomeid, et kattuda ümbritseva aatomi orbitaaliga.
Elektrofiilsed liitumisreaktsioonid
Nendes reaktsioonides on ründavaks osakeseks elektrofiil.
Halogeenimine:
Hüdrohalogeenimine
Vesinikhalogeniidide elektrofiilne lisamine alkeenidele toimub Markovnikovi reegli kohaselt
Markovnikovi valitsemine
Hüpokloorhappe lisamine klorohüdriinide moodustamiseks:
Niisutus
Vee lisamine alkeenidele toimub väävelhappe juuresolekul:
Karbokatsioon- osake, milles positiivne laeng on koondunud süsinikuaatomile; süsinikuaatomil on vaba p-orbitaal.
14. Etüleensüsivesinikud. Keemilised omadused: reaktsioonid oksüdeerivate ainetega. Katalüütiline oksüdatsioon, reaktsioon perhapetega, oksüdatsioonireaktsioon glükoolideks, süsinik-süsinik sideme lõhustamisega, osoonimine. Wackeri protsess. Asendusreaktsioonid.
Alkeenid (olefiinid, etüleeni süsivesinikud) - atsüklilised küllastumata süsivesinikud, mis sisaldavad ühte kaksiksidet süsinikuaatomite vahel, moodustades homoloogse rea üldvalemiga C n H 2n
Oksüdatsioon
Alkeenide oksüdeerumine võib toimuda olenevalt oksüdeerivate reaktiivide tingimustest ja tüüpidest nii kaksiksideme lõhustamisega kui ka süsinikskeleti säilimisega.
Õhus põletades toodavad olefiinid süsihappegaasi ja vett.
H 2 C=CH 2 + 3O 2 => 2CO 2 + 2H 2 O
C n H 2n+ 3n/O 2 => nCO 2 + nH 2 O – üldvalem
Katalüütiline oksüdatsioon
Pallaadiumisoolade juuresolekul oksüdeeritakse etüleen atseetaldehüüdiks. Atsetoon tekib propeenist samamoodi.
Kui alkeenid puutuvad kokku tugevate oksüdeerivate ainetega (KMnO 4 või K 2 Cr 2 O 7 H 2 SO 4-s), katkeb kaksikside kuumutamisel:
Kui alkeenid oksüdeeritakse kaaliumpermanganaadi lahjendatud lahusega, tekivad kahehüdroksüülsed alkoholid - glükoolid (E.E. Wagneri reaktsioon). Reaktsioon toimub külmas.
Atsüklilised ja tsüklilised alkeenid, reageerides perhapetega RCOOOH mittepolaarses keskkonnas, moodustavad epoksiide (oksiraanid), mistõttu reaktsiooni ennast nimetatakse epoksüdatsioonireaktsiooniks.

Alkeenide osoonimine.
Kui alkeenid interakteeruvad osooniga, tekivad peroksiidühendid, mida nimetatakse osoniidideks. Alkeenide reaktsioon osooniga on kõige olulisem meetod alkeenide oksüdatiivseks lõhustamiseks kaksiksideme juures
Alkeenid ei läbi asendusreaktsioone.
Wackeri protsess- atseetaldehüüdi tootmise protsess etüleeni otsesel oksüdatsioonil.
Wackeri protsess põhineb etüleeni oksüdeerimisel pallaadiumdikloriidiga:
CH2 = CH2 + PdCl2 + H2O = CH3CHO + Pd + 2HCl
15. Alkeenid: keemilised omadused. Hüdrogeenimine. Lebedevi reegel. Alkeenide isomerisatsioon ja oligomerisatsioon. Radikaalne ja ioonne polümerisatsioon. Polümeeri, oligomeeri, monomeeri, elementaarühiku, polümerisatsiooniastme mõiste. Telomerisatsioon ja kopolümerisatsioon.
Hüdrogeenimine
Alkeenide hüdrogeenimine otse vesinikuga toimub ainult katalüsaatori juuresolekul. Hüdrogeenimiskatalüsaatorite hulka kuuluvad plaatina, pallaadium ja nikkel.
Hüdrogeenimist saab läbi viia ka vedelas faasis homogeensete katalüsaatoritega
Isomerisatsioonireaktsioonid
Kuumutamisel on võimalik alkeeni molekulide isomerisatsioon, mis
võib põhjustada nii kaksiksideme liikumist kui ka skeleti muutusi
süsivesinik.
CH2=CH-CH2-CH3 CH3-CH=CH-CH3
Polümerisatsioonireaktsioonid
See on teatud tüüpi liitmisreaktsioon. Polümerisatsioon on identsete molekulide järjestikuse kombineerimise reaktsioon suuremateks molekulideks, eraldamata madala molekulmassiga toodet. Polümerisatsiooni käigus lisatakse kaksiksideme juures kõige enam hüdrogeenitud süsinikuaatomile vesinikuaatom ja ülejäänud molekul lisatakse teisele süsinikuaatomile.
CH2=CH2 + CH2=CH2 + ... -CH2-CH2-CH2-CH2- ...
või n CH2=CH2 (-CH2-CH2-)n (polüetüleen)
Ainet, mille molekulid läbivad polümerisatsioonireaktsiooni, nimetatakse monomeer. Monomeeri molekulis peab olema vähemalt üks kaksikside. Saadud polümeerid koosnevad suurest hulgast korduvatest ahelatest, millel on sama struktuur ( elementaarühikud). Nimetatakse arvu, mis näitab, mitu korda kordub struktuurne (elementaar)üksus polümeeris polümerisatsiooniaste(n).
Sõltuvalt polümerisatsiooni käigus tekkivate vaheosakeste tüübist on 3 polümerisatsioonimehhanismi: a) radikaal; b) katioonsed; c) anioonsed.
Esimese meetodiga toodetakse suure tihedusega polüetüleeni:
Reaktsiooni katalüsaatoriks on peroksiidid.
Teine ja kolmas meetod hõlmavad hapete (katioonne polümerisatsioon) ja metallorgaaniliste ühendite kasutamist katalüsaatoritena.
Keemias oligomeer) – ahela kujul olev molekul väike identsete koostisosade arv.
Telomerisatsioon
Telomerisatsioon on alkeenide oligomerisatsioon ahela ülekandeainete (telogeenide) juuresolekul. Reaktsiooni tulemusena moodustub oligomeeride (telomeeride) segu, mille lõpprühmad on telogeeni osad. Näiteks CCl4 reaktsioonis etüleeniga on telogeeniks CCl4.
CCl4 + nCH2 =CH2 => Cl(CH2CH2)nCCl3
Neid reaktsioone saab käivitada radikaalsete initsiaatorite või g-kiirgusega.
16. Alkeenid. Halogeenide ja vesinikhalogeniidide radikaalse liitumise reaktsioonid (mehhanism). Karbeenide lisamine olefiinidele. Etüleen, propüleen, butüleen. Tööstuslikud allikad ja peamised kasutusalad.
Alkeenid lisavad kergesti halogeene, eriti kloori ja broomi (halogeenimine).
Seda tüüpi tüüpiline reaktsioon on broomivee värvimuutus
CH2=CH2 + Br2 → CH2Br-CH2Br (1,2-dibromoetaan)
Vesinikhalogeniidide elektrofiilne lisamine alkeenidele toimub vastavalt Markovnikovi reeglile:
Markovnikovi valitsemine: protoonsete hapete või vee lisamisel ebasümmeetrilistele alkeenidele või alküünidele lisatakse vesinik kõige enam hüdrogeenitud süsinikuaatomile
Hüdrogeenitud süsinikuaatom on see, mille külge on kinnitatud vesinik. Enim hüdrogeenitud – kus on kõige rohkem H
Karbeeni liitumisreaktsioonid
CR 2 karbeenid: - väga reaktiivsed lühiealised liigid, mis võivad kergesti liituda alkeenide kaksiksidemega. Karbeeni liitumisreaktsiooni tulemusena tekivad tsüklopropaani derivaadid
Etüleen on orgaaniline kemikaal, mida kirjeldatakse valemiga C2H4. Kas kõige lihtsam alkeen ( olefiin)ühend. Tavatingimustes on see nõrga lõhnaga värvitu kergestisüttiv gaas. Vees osaliselt lahustuv. Sisaldab kaksiksidet ja kuulub seetõttu küllastumata või küllastumata süsivesinike hulka. Mängib tööstuses äärmiselt olulist rolli. Etüleen on maailmas enim toodetud orgaaniline ühend: etüleenoksiid; polüetüleen, äädikhape, etüülalkohol.
Põhilised keemilised omadused(ära mind õpeta, lase neil igaks juhuks kohal olla, juhuks, kui nad saavad selle maha kanda)
Etüleen on keemiliselt aktiivne aine. Kuna molekulis on süsinikuaatomite vahel kaksikside, puruneb üks neist, mis on vähem tugev, kergesti ja sideme katkemise kohas toimub molekulide kinnitumine, oksüdatsioon ja polümerisatsioon.
Halogeenimine:
CH2 =CH2 + Br2 → CH2Br-CH2Br
Broomivesi muutub värvituks. See on kvalitatiivne reaktsioon küllastumata ühenditele.
Hüdrogeenimine:
CH 2 = CH 2 + H - H → CH 3 - CH 3 (Ni mõjul)
Hüdrohalogeenimine:
CH2 =CH2 + HBr → CH3 - CH2Br
Niisutus:
CH 2 =CH 2 + HOH → CH 3 CH 2 OH (katalüsaatori mõjul)
Selle reaktsiooni avastas A.M. Butlerov ja seda kasutatakse etüülalkoholi tööstuslikuks tootmiseks.
Oksüdatsioon:
Etüleen oksüdeerub kergesti. Kui etüleen lastakse läbi kaaliumpermanganaadi lahuse, muutub see värvituks. Seda reaktsiooni kasutatakse küllastunud ja küllastumata ühendite eristamiseks. Etüleenoksiid on habras aine, hapnikusild puruneb ja vesi liitub, mille tulemusena moodustub etüleenglükool. Reaktsiooni võrrand:
3CH2 =CH2 + 2KMnO4 + 4H2O → 3HOH2C - CH2OH + 2MnO2 + 2KOH
C2H4 + 3O2 → 2CO2 + 2H2O
Polümerisatsioon (polüetüleeni tootmine):
nCH2 =CH2 → (-CH2-CH2-) n
Propüleen(propeen) CH 2 = CH-CH 3 - küllastumata (küllastumata) süsivesinik etüleeni seeriast, tuleohtlik gaas. Propüleen on gaasiline aine madala keemistemperatuuriga t keemistemperatuur = −47,6 °C
Tavaliselt eraldatakse propüleen nafta rafineerimisgaasidest (toornafta krakkimise, bensiinifraktsioonide pürolüüsi käigus) või sellega seotud gaasidest, samuti kivisöe koksistamise gaasidest.
Küllastumata hulka kuuluvad süsivesinikud, mis sisaldavad oma molekulides mitut sidet süsinikuaatomite vahel. Neid on piiramatud alkeenid, alküünid, alkadieenid (polüeenid). Küllastumata on ka tsüklilised süsivesinikud, mis sisaldavad tsüklis kaksiksidet (tsükloalkeenid), aga ka väikese arvu süsinikuaatomitega tsüklis (kolm või neli aatomit) tsükloalkaanid. "Küllastumatuse" omadus on seotud nende ainete võimega siseneda liitumisreaktsioonid, peamiselt vesinik, koos küllastunud või küllastunud süsivesinike - alkaanide moodustumisega.
Alkeenide struktuur
Atsüklilised süsivesinikud, mis sisaldavad molekulis lisaks üksiksidemetele üht kaksiksidet süsinikuaatomite vahel ja vastavad üldvalemile C n H 2n.
Selle teine nimi on olefiinid- alkeenid saadi analoogselt küllastumata rasvhapetega (oleic, linoleic), mille jäänused on osa vedelast rasvast - õlidest (inglise keelest oil - oil).
Süsinikuaatomid, mille vahel on kaksikside, on olekus sp 2 -hübridisatsioon. See tähendab, et hübridisatsioonis osalevad üks s- ja kaks p-orbitaali ning üks p-orbitaal jääb hübridiseerimata.

Hübriidorbitaalide kattumine viib σ-sideme tekkeni ja naabersüsinikuaatomite hübridiseerimata p-orbitaalide tõttu tekib teine, π side. Seega koosneb kaksikside ühest σ- ja üks π-side.
Kaksiksidet moodustavate aatomite hübriidorbitaalid on samas tasapinnas ja π-sidet moodustavad orbitaalid on risti molekuli tasandiga.
Kaksikside (0,132 nm) on lühem kui üksikside ja selle energia on suurem, kuna see on tugevam. Liikuva, kergesti polariseeruva π-sideme olemasolu toob aga kaasa asjaolu, et alkeenid on keemiliselt aktiivsemad kui alkaanid ja on võimelised läbima liitumisreaktsioone.

Alkeenide homoloogne seeria
Alkeenide homoloogse seeria kolm esimest liiget on gaasid, C5H10-st C17H34-ni on vedelikud ja C18H36-st tahked ained. Vedelad ja tahked alkeenid on vees praktiliselt lahustumatud, kuid lahustuvad hästi orgaanilistes lahustites.
Vastavalt IUPAC-i reeglitele kasutatakse paljude alkeenide homoloogide nimetustes järelliidet -een. Kaksiksideme asukohta tähistab number, mis näitab sideme asukohta. Number asetatakse peaahela nime järele ja eraldatakse sidekriipsuga. Aatomite nummerdamine alkeeni molekulis algab otsast, millele side on kõige lähemal, näiteks valemile CH 3 −CH 2 −CH=CH−CH 3 vastavat alkeeni tuleks nimetada penten-2, kuna side algab teisest süsinikuaatomist, alustades lõppahelatest.
Hargnemata alkeenid moodustavad eteeni (etüleeni) homoloogse seeria: C 2 H 4 - eteen, C 3 H 6 - propeen, C 4 H 8 - buteen, C 5 H 10 - penteen, C 6 H 12 - hekseen jne.
Alkeenide isomeeria ja nomenklatuur
Alkeenidele ja ka alkaanidele on see iseloomulik struktuurne isomeeria. Struktuuriisomeerid erinevad üksteisest süsiniku skeleti struktuuri poolest. Lihtsaim alkeen, mida iseloomustavad struktuursed isomeerid, on buteen.

Struktuurse isomeeria eritüüp on kaksiksideme positsiooni isomeeria:
Süsinikuaatomite peaaegu vaba pöörlemine on võimalik ühe süsinik-süsinik sideme ümber, nii et alkaani molekulid võivad võtta väga erinevaid kujundeid. Pöörlemine kaksiksideme ümber on võimatu, mis põhjustab alkeenides teist tüüpi isomeeria ilmnemist - geomeetriline, või cis-trans isomeeria.

Cis-isomeerid erinevad trans-isomeeridest molekulaarsete fragmentide (antud juhul metüülrühmade) ruumilise paigutuse poolest π-sideme tasandi suhtes ja sellest tulenevalt ka oma omaduste poolest.
Alkeenid on tsükloalkaanide suhtes isomeersed (klassidevaheline isomeeria), näiteks:

Alkeenide IUPAC-i nomenklatuur on alkaanide omaga sarnane.
1. Põhiahela valik. Süsivesiniku nime kujunemine algab peaahela – molekuli pikima süsinikuaatomite ahela – määratlemisest. Alkeenide puhul peab põhiahel sisaldama kaksiksidet.
2. Peaahela aatomite nummerdamine. Peaahela aatomite nummerdamine algab otsast, millele kaksikside on kõige lähemal. Näiteks on õige ühenduse nimi:

5-metüülhekseen-2, mitte 2-metüülhekseen-4, nagu võiks eeldada.
Kui kaksiksideme asend ei suuda määrata aatomite numeratsiooni algust ahelas, siis määratakse see asendajate asukoha järgi samamoodi nagu küllastunud süsivesinike puhul.

3. Nime kujunemine. Alkeenide nimed moodustatakse samamoodi nagu alkaanide nimed. Nime lõppu märkige süsinikuaatomi number, millest kaksikside algab, ja järelliide -een, mis näitab, et ühend kuulub alkeenide klassi. Näiteks:

Alkeenide füüsikalised omadused
Esiteks kolm alkeenide homoloogse seeria esindajat- gaasid; ained koostisega C 5 H 10 - C 16 H 32 - vedelikud; Kõrgemad alkeenid on tahked ained.
Keemis- ja sulamistemperatuurid tõusevad loomulikult koos ühendite molekulmassi suurenemisega.
Alkeenide keemilised omadused
Lisamisreaktsioonid. Tuletagem meelde, et küllastumata süsivesinike - alkeenide - esindajate eripäraks on võime osaleda liitumisreaktsioonides. Enamik neist reaktsioonidest kulgeb vastavalt mehhanismile elektrofiilne lisamine.
1. Alkeenide hüdrogeenimine. Alkeenid on võimelised lisama vesinikku hüdrogeenimiskatalüsaatorite, metallide - plaatina, pallaadiumi, nikli juuresolekul:
See reaktsioon toimub atmosfäärirõhul ja kõrgendatud rõhul ega vaja kõrget temperatuuri, kuna see on eksotermiline. Kui temperatuur tõuseb, võivad samad katalüsaatorid põhjustada pöördreaktsiooni – dehüdrogeenimist.
2. Halogeenimine(halogeenide lisamine). Alkeeni interaktsioon broomveega või broomi lahusega orgaanilises lahustis (CCl 4) põhjustab nende lahuste kiiret värvimuutust, mis tuleneb halogeeni molekuli lisamisest alkeenile ja dihaloalkaanide moodustumisest:
3. Hüdrohalogeenimine(vesinikhalogeniidi lisamine).
See reaktsioon kuuletub Markovnikovi reegel:
Kui vesinikhalogeniid seostub alkeeniga, kinnitub vesinik rohkem hüdrogeenitud süsinikuaatomiga, st aatomiga, millel on rohkem vesinikuaatomeid, ja halogeen vähem hüdrogeenitud süsinikuaatomiga.
4. Niisutus(veeühendus). Alkeenide hüdratsioon põhjustab alkoholide moodustumist. Näiteks vee lisamine eteenile on ühe etüülalkoholi tootmise tööstusliku meetodi aluseks:
Pange tähele, et primaarne alkohol (mille primaarsel süsinikul on hüdroksorühm) moodustub ainult siis, kui eteen on hüdraatunud. Propeeni või teiste alkeenide hüdraatumisel tekivad sekundaarsed alkoholid.

See reaktsioon kulgeb samuti vastavalt Markovnikovi reegel- vesinikkatioon on seotud rohkem hüdrogeenitud süsinikuaatomiga ja hüdroksorühm lisatakse vähem hüdrogeenitud aatomile.
5. Polümerisatsioon. Lisamise erijuhtum on alkeenide polümerisatsioonireaktsioon:
See liitumisreaktsioon toimub vabade radikaalide mehhanismi kaudu.
Oksüdatsioonireaktsioonid.
1. Põlemine. Nagu kõik orgaanilised ühendid, põlevad alkeenid hapnikus, moodustades CO 2 ja H 2 O:

2. Oksüdatsioon lahustes. Erinevalt alkaanidest oksüdeeruvad alkeenid kergesti kaaliumpermanganaadi lahustega. Neutraalsetes või leeliselistes lahustes oksüdeeritakse alkeenid dioolideks (dihüdroksüülsed alkoholid) ja hüdroksüülrühmad lisatakse nendele aatomitele, mille vahel oli enne oksüdeerimist kaksikside:

Alkeene iseloomustavad peamiselt reaktsioonid ühinemine topeltsideme kaudu. Põhimõtteliselt kulgevad need reaktsioonid ioonmehhanismi abil. Pi side katkeb ja moodustub kaks uut sigma sidet. Tuletan meelde, et asendusreaktsioonid olid alkaanidele tüüpilised ja järgisid radikaalset mehhanismi. Vesinikumolekulid võivad kinnituda alkeenidega; neid reaktsioone nimetatakse hüdrogeenimiseks, veemolekulideks, hüdratsiooniks, halogeenide halogeenimiseks, vesinikhalogeniidide hüdrohalogeenimiseks. Aga kõigepealt asjad kõigepealt.
Topeltsideme liitumisreaktsioonid
Niisiis, esiteks keemiline omadus vesinikhalogeniidide lisamise võime, hüdrohalogeenimine.
Propeen ja teised alkeenid reageerivad Markovnikovi reegli kohaselt vesinikhalogeniididega.

Vesinikuaatom kinnitub kõige enam hüdrogeenitud või õigemini hüdrogeenitud süsinikuaatomiga.
Teiseks number meie omaduste nimekirjas oleks hüdratatsioon, vee lisamine.
Reaktsioon toimub kuumutamisel happe, tavaliselt väävel- või fosforhappe manulusel. Vee lisamine toimub ka Markovnikovi reegli järgi, see tähendab, et primaarset alkoholi saab saada ainult etüleeni hüdraatimisel, ülejäänud hargnemata alkeenid annavad sekundaarseid alkohole.
Markovnikovi reeglist on erandeid nii hüdrohalogeenimise kui ka hüdratatsiooni kohta. Esiteks, vastupidiselt sellele reeglile, lisamine toimub peroksiidide juuresolekul.
Teiseks alkeenide derivaatide puhul, milles esinevad elektrone tõmbavad rühmad. Näiteks 3,3,3-trifluoropropeen-1 jaoks.

Fluori aatomid tõmbavad oma suure elektronegatiivsuse tõttu sigma sidemete ahela kaudu enda poole elektrontihedust. Seda nähtust nimetatakse negatiivseks induktiivseks efektiks.

Seetõttu nihkuvad kaksiksideme liikuvad pi-elektronid ja kõige välimine süsinikuaatom saab osalise positiivse laenguga, mida tavaliselt tähistatakse kui delta pluss. Just sellele läheb negatiivselt laetud broomiioon ja vesiniku katioon kinnitub kõige vähem hüdrogeenitud süsinikuaatomiga.
Lisaks trifluorometüülrühmale omavad negatiivset induktsiooniefekti näiteks triklorometüülrühm, nitrorühm, karboksüülrühm ja mõned teised.
See teine Markovnikovi reegli rikkumise juhtum ühtsel riigieksamil on väga haruldane, kuid siiski on soovitatav seda meeles pidada, kui plaanite eksami sooritada maksimaalse punktisummaga.
Kolmandaks halogeeni molekulide keemilised omadused.

See puudutab peamiselt broomi, kuna see reaktsioon on mitme sideme korral kvalitatiivne. Kui näiteks etüleen lastakse läbi broomivee, st broomi lahuse vees, mis on pruuni värvi, muutub see värvituks. Kui lasete gaaside segu, näiteks etaani ja eteeni, läbi broomivee, saate puhta etaani ilma eteeni lisanditeta, kuna see jääb reaktsioonikolbi dibromoetaani kujul, mis on vedelik.
Eriti tähelepanuväärne on alkeenide reaktsioon gaasifaasis tugeva kuumutamisega, näiteks klooriga.
Sellistes tingimustes ei toimu mitte liitumisreaktsioon, vaid asendusreaktsioon. Veelgi enam, eranditult alfa-süsinikuaatomi juures, st kaksiksidemega külgneval aatomil. Sel juhul saadakse 3-kloropropeen-1. Neid reaktsioone esineb eksamil harva, mistõttu enamik õpilasi ei mäleta neid ja reeglina teevad vigu.
Neljandaks number on hüdrogeenimisreaktsioon ja koos sellega ka dehüdrogeenimisreaktsioon. See tähendab vesiniku lisamist või eemaldamist.

Hüdrogeenimine toimub nikkelkatalüsaatoril mitte väga kõrgel temperatuuril. Kõrgematel temperatuuridel on alküünide saamiseks võimalik dehüdrogeenida.
Viiendaks Alkeenide omadus on polümeriseerumisvõime, kui sajad ja tuhanded alkeeni molekulid moodustavad pi-sideme katkemise ja üksteisega sigma-sidemete tekkimise tõttu väga pikki ja tugevaid ahelaid.
Sel juhul oli tulemuseks polüetüleen. Pange tähele, et saadud molekul ei sisalda mitut sidet. Selliseid aineid nimetatakse polümeerideks, algmolekule nimetatakse monomeerideks, korduv fragment on polümeeri elementaarühik ja arv n on polümerisatsiooniaste.
Võimalikud on ka reaktsioonid muude oluliste polümeersete materjalide, näiteks polüpropüleeni tootmiseks.


Teine oluline polümeer on polüvinüülkloriid.

Selle polümeeri tootmise lähteaineks on kloroetaan, mille üldnimetus on vinüülkloriid. Kuna seda küllastumata asendajat nimetatakse vinüüliks. Plasttoodetel sageli esinev lühend PVC tähistab polüvinüülkloriidi.
Arutasime viit omadust, mis esindasid kaksiksideme liitumisreaktsioone. Vaatame nüüd reaktsioone oksüdatsioon.
Alkeenide oksüdatsioonireaktsioonid
Kuues keemiline omadus meie üldnimekirjas on kerge oksüdatsioon või Wagneri reaktsioon. See tekib siis, kui alkeen puutub külma käes kokku kaaliumpermanganaadi vesilahusega, mistõttu on eksamiülesannetes sageli märgitud null kraadine temperatuur.
Tulemuseks on kahehüdroksüülne alkohol. Sel juhul nimetatakse etüleenglükooli ja üldiselt selliseid alkohole ühiselt glükoolideks. Reaktsiooni käigus muutub lillakasroosa permanganaadi lahus värvust, seega on see reaktsioon kvalitatiivne ka kaksiksideme jaoks. Mangaan taandub neutraalses keskkonnas oksüdatsiooniastmelt +7 oksüdatsiooniastmeni +4. Vaatame veel paar näidet. VÕRRAND
Siin saame propaandiool-1,2. Kuid tsüklilised alkeenid reageerivad samal viisil. VÕRRAND
Teine võimalus on see, kui kaksikside asub näiteks aromaatsete süsivesinike külgahelas. Wagneri reaktsiooni, mis hõlmab stüreeni, selle teine nimi on vinüülbenseen, kohtab eksamiülesannetes regulaarselt.

Loodan, et olen toonud teile piisavalt näiteid, et mõistaksite, et kaksiksideme kerge oksüdeerimine toimub alati üsna lihtsa reegli järgi: pi-side katkeb ja igale süsinikuaatomile lisatakse hüdroksüülrühm.
Nüüd kõva oksüdatsiooni kohta. See saab olema meie oma seitsmes vara. See oksüdatsioon toimub siis, kui alkeen reageerib kuumutamisel happelise kaaliumpermanganaadi lahusega.
Toimub molekuli hävimine, see tähendab selle hävimine kaksiksideme juures. Buteen-2 puhul saadi kaks äädikhappe molekuli. Üldiselt saab mitmiksideme asukohta süsinikuahelas hinnata oksüdatsiooniproduktide põhjal.
Buteen-1 oksüdeerimisel tekib propioonhappe (propaanhappe) ja süsinikdioksiidi molekul.
Etüleeni puhul saate kaks süsinikdioksiidi molekuli. Happelises keskkonnas väheneb mangaan kõigil juhtudel oksüdatsiooniastmelt +7 kuni +2.
Ja lõpuks kaheksas omadus täielik oksüdatsioon või põlemine.
Alkeenid põlevad, nagu ka teised süsivesinikud, süsinikdioksiidiks ja veeks. Kirjutame üles alkeenide põlemise võrrandi üldkujul.
Süsinikdioksiidi molekule on sama palju kui alkeeni molekulis on süsiniku aatomeid, kuna CO 2 molekul sisaldab ühte süsinikuaatomit. See tähendab n CO 2 molekuli. Veemolekule on kaks korda vähem kui vesinikuaatomeid, see tähendab 2n/2, mis tähendab vaid n.
Vasakul ja paremal on sama palju hapnikuaatomeid. Paremal on 2n süsihappegaasi pluss n vett, kokku 3n. Vasakul on sama arv hapnikuaatomeid, mis tähendab, et molekule on kaks korda vähem, kuna molekul sisaldab kahte aatomit. See tähendab 3n/2 hapniku molekuli. Saate kirjutada 1,5n.
Oleme üle vaadanud kaheksa alkeenide keemilised omadused.
Alkaanide keemilised omadused
Alkaanid (parafiinid) on mittetsüklilised süsivesinikud, mille molekulides on kõik süsinikuaatomid ühendatud ainult üksiksidemetega. Teisisõnu, alkaanimolekulides ei ole mitmik- või kolmiksidemeid. Tegelikult on alkaanid süsivesinikud, mis sisaldavad võimalikult palju vesinikuaatomeid ja seetõttu nimetatakse neid piiravateks (küllastunud).
Küllastumise tõttu ei saa alkaanid läbida liitumisreaktsioone.
Kuna süsiniku ja vesiniku aatomitel on üsna lähedane elektronegatiivsus, viib see tõsiasjani, et nende molekulide CH-sidemed on äärmiselt madala polaarsusega. Sellega seoses on alkaanide puhul tüüpilisemad reaktsioonid, mis kulgevad radikaalse asendusmehhanismi kaudu, mida tähistatakse sümboliga SR.
1. Asendusreaktsioonid
Seda tüüpi reaktsioonides katkevad süsinik-vesiniksidemed
RH + XY → RX + HY
Halogeenimine
Alkaanid reageerivad halogeenidega (kloor ja broom), kui nad puutuvad kokku ultraviolettvalguse või kõrge kuumusega. Sel juhul moodustub vesinikuaatomite erineva asendusastmega halogeeni derivaatide segu - mono-, ditri- jne. halogeen-asendatud alkaanid.
Kasutades näiteks metaani, näeb see välja järgmine:
Muutes reaktsioonisegus halogeeni/metaani suhet, on võimalik tagada, et toodete koostises domineerib konkreetne metaani halogeenderivaat.
|
Reaktsioonimehhanism Analüüsime vabade radikaalide asendusreaktsiooni mehhanismi metaani ja kloori interaktsiooni näitel. See koosneb kolmest etapist:
Vabad radikaalid, nagu on näha ülaltoodud jooniselt, on aatomid või aatomirühmad, millel on üks või enam paardumata elektroni (Cl, H, CH 3, CH 2 jne); 2. Ahela arendamine See etapp hõlmab aktiivsete vabade radikaalide interaktsiooni mitteaktiivsete molekulidega. Sel juhul moodustuvad uued radikaalid. Eelkõige siis, kui klooriradikaalid mõjutavad alkaanimolekule, moodustub alküülradikaal ja vesinikkloriid. Alküülradikaal, põrkudes kloori molekulidega, moodustab omakorda kloori derivaadi ja uue klooriradikaali: 3) Keti katkemine (surm): Tekib kahe radikaali rekombinatsiooni tulemusena üksteisega mitteaktiivseteks molekulideks: |
2. Oksüdatsioonireaktsioonid
Normaalsetes tingimustes on alkaanid inertsed selliste tugevate oksüdeerivate ainete suhtes nagu kontsentreeritud väävel- ja lämmastikhape, kaaliumpermanganaat ja dikromaat (KMnO 4, K 2 Cr 2 O 7).
Põlemine hapnikus
A) täielik põlemine liigse hapnikuga. Viib süsihappegaasi ja vee moodustumiseni:
CH 4 + 2O 2 = CO 2 + 2H 2 O
B) mittetäielik põlemine hapnikupuuduse tõttu:
2CH4 + 3O2 = 2CO + 4H2O
CH4 + O2 = C + 2H2O
Katalüütiline oksüdatsioon hapnikuga
Alkaanide hapnikuga (~200 o C) kuumutamise tulemusena katalüsaatorite juuresolekul saab neist väga erinevaid orgaanilisi tooteid: aldehüüde, ketoone, alkohole, karboksüülhappeid.
Näiteks võib metaani olenevalt katalüsaatori olemusest oksüdeerida metüülalkoholiks, formaldehüüdiks või sipelghappeks:
3. Alkaanide termilised muundumised
Pragunemine
Krakkimine (inglise keelest crack - to tear) on kõrgetel temperatuuridel toimuv keemiline protsess, mille tulemusena alkaanimolekulide süsinikskelett laguneb, moodustades algsete alkaanidega võrreldes väiksema molekulmassiga alkeenide ja alkaanide molekule. Näiteks:
CH3-CH2-CH2-CH2-CH2-CH2-CH3 → CH3-CH2-CH2-CH3 + CH3-CH=CH2
Krakkimine võib olla termiline või katalüütiline. Katalüütilise krakkimise läbiviimiseks kasutatakse tänu katalüsaatorite kasutamisele termilise krakkimisega võrreldes oluliselt madalamaid temperatuure.
Dehüdrogeenimine
Vesiniku elimineerimine toimub CH-sidemete lõhustumise tulemusena; viiakse läbi katalüsaatorite juuresolekul kõrgendatud temperatuuridel. Metaani dehüdrogeenimisel moodustub atsetüleen:
2CH4 → C2H2 + 3H2
Metaani kuumutamine temperatuurini 1200 °C viib selle lagunemiseni lihtsateks aineteks:
CH4 → C + 2H 2
Ülejäänud alkaanide dehüdrogeenimisel tekivad alkeenid:
C2H6 → C2H4 + H2
Dehüdrogeenimisel n-butaan toodab buteeni või buteen-2 (segu cis- Ja transs-isomeerid):
Dehüdrotsüklistamine
Isomerisatsioon
Tsükloalkaanide keemilised omadused
Tsükloalkaanide, mille tsüklites on rohkem kui neli süsinikuaatomit, keemilised omadused on üldiselt peaaegu identsed alkaanide omadustega. Kummalisel kombel iseloomustavad tsüklopropaani ja tsüklobutaani liitumisreaktsioonid. See on tingitud kõrgest pingest tsükli sees, mis viib selleni, et need tsüklid kipuvad katkema. Nii et tsüklopropaan ja tsüklobutaan lisavad kergesti broomi, vesinikku või vesinikkloriidi:
Alkeenide keemilised omadused
1. Lisamisreaktsioonid
Kuna alkeeni molekulide kaksikside koosneb ühest tugevast sigma- ja ühest nõrgast pi-sidemest, on need üsna aktiivsed ühendid, mis kergesti läbivad liitumisreaktsioone. Alkeenid läbivad sageli selliseid reaktsioone isegi kergetes tingimustes - külmas, vesilahustes ja orgaanilistes lahustites.
Alkeenide hüdrogeenimine
Alkeenid on võimelised lisama vesinikku katalüsaatorite (plaatina, pallaadium, nikkel) juuresolekul:
CH3-CH = CH2 + H2 → CH3-CH2-CH3
Alkeenide hüdrogeenimine toimub kergesti isegi normaalrõhul ja vähesel kuumutamisel. Huvitav fakt on see, et alkaanide alkeenideks dehüdrogeenimisel saab kasutada samu katalüsaatoreid, ainult dehüdrogeenimisprotsess toimub kõrgemal temperatuuril ja madalamal rõhul.
Halogeenimine
Alkeenid läbivad kergesti liitumisreaktsiooni broomiga nii vesilahuses kui ka orgaanilistes lahustites. Interaktsiooni tulemusena kaotavad esialgu kollased broomilahused oma värvi, s.t. värvi muutma.
CH2 =CH2 + Br2 → CH2Br-CH2Br
Hüdrohalogeenimine
Nagu on lihtne näha, peaks vesinikhalogeniidi lisamine ebasümmeetrilise alkeeni molekulile teoreetiliselt viima kahe isomeeri seguni. Näiteks kui propeenile lisatakse vesinikbromiidi, tuleks saada järgmised tooted:
Kuid spetsiifiliste tingimuste puudumisel (näiteks peroksiidide olemasolu reaktsioonisegus) toimub vesinikhalogeniidi molekuli lisamine rangelt selektiivselt vastavalt Markovnikovi reeglile:
Vesinikhalogeniidi lisamine alkeenile toimub nii, et suurema arvu vesinikuaatomitega süsinikuaatomile lisatakse vesinik (rohkem hüdrogeenitud) ja vähema vesiniku arvuga süsinikuaatomile lisatakse halogeen aatomid (vähem hüdrogeenitud).
Niisutus
See reaktsioon viib alkoholide moodustumiseni ja kulgeb ka vastavalt Markovnikovi reeglile:
Nagu võite kergesti arvata, on Markovnikovi reegli kohaselt võimalik primaarse alkoholi moodustumine ainult etüleeni hüdratatsiooni korral, kuna alkeeni molekulile lisatakse vett:
CH2 =CH2 + H20 → CH3-CH2-OH
Just selle reaktsiooni kaudu viiakse suurtööstuses läbi suurem osa etüülalkoholist.
Polümerisatsioon
Konkreetne liitumisreaktsiooni juhtum on polümerisatsioonireaktsioon, mis erinevalt halogeenimisest, hüdrohalogeenimisest ja hüdratsioonist toimub vabade radikaalide mehhanismi kaudu:
Oksüdatsioonireaktsioonid
Nagu kõik teised süsivesinikud, põlevad alkeenid kergesti hapnikus, moodustades süsinikdioksiidi ja vett. Alkeenide põlemise võrrand liigses hapnikus on järgmine:
Cn H 2n+2 + O2 → nCO2 + (n+1)H2O
Erinevalt alkaanidest oksüdeeruvad alkeenid kergesti. Kui alkeenid puutuvad kokku KMnO 4 vesilahusega, tekib värvimuutus, mis on kvalitatiivne reaktsioon orgaaniliste ainete molekulide topelt- ja kolmiksidemetele.
Alkeenide oksüdeerimine kaaliumpermanganaadiga neutraalses või nõrgalt leeliselises lahuses põhjustab dioolide (dihüdroksüülsete alkoholide) moodustumist:
C 2 H 4 + 2KMnO 4 + 2H 2 O → CH 2 OH–CH 2 OH + 2 MnO 2 + 2KOH (jahutus)
Happelises keskkonnas katkeb kaksikside täielikult ja kaksiksideme moodustanud süsinikuaatomid muudetakse karboksüülrühmadeks:
5CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5C 2 H 5 COOH + 8 MnSO 4 + 4K 2 SO 4 + 17H 2 O (küte)
Kui C=C kaksikside asub alkeeni molekuli otsas, tekib kaksiksideme äärepoolseima süsinikuaatomi oksüdatsiooniproduktina süsinikdioksiid. Selle põhjuseks on asjaolu, et oksüdatsiooni vaheprodukt, sipelghape, oksüdeerub kergesti oksüdeeriva aine liias:
5CH 3 CH=CH 2 + 10 KMnO 4 + 15H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 10 MnSO 4 + 5K 2 SO 4 + 20 H 2 O (küte)
Alkeenide oksüdeerimine, milles kaksiksideme C-aatom sisaldab kahte süsivesiniku asendajat, tekitab ketooni. Näiteks 2-metüülbuteen-2 oksüdeerimisel tekib atsetoon ja äädikhape.
Nende struktuuri määramiseks kasutatakse alkeenide oksüdatsiooni, mille käigus kaksiksideme juurest lõhutakse süsiniku karkass.
Alkadieenide keemilised omadused
Lisamisreaktsioonid
Näiteks halogeenide lisamine:
Broomivesi muutub värvituks.
Normaaltingimustes toimub halogeeniaatomite lisamine 1,3-butadieeni molekuli otstes, samal ajal kui π-sidemed katkevad, äärmuslikele süsinikuaatomitele lisatakse broomiaatomid ja vabad valentsid moodustavad uue π-sideme . Seega toimub kaksiksideme "liikumine". Kui broomi on liiga palju, võib moodustunud kaksiksideme kohta lisada teise molekuli.
Polümerisatsioonireaktsioonid
Alküünide keemilised omadused
Alküünid on küllastumata (küllastumata) süsivesinikud ja seetõttu võivad nad läbida liitumisreaktsioone. Alküünide liitumisreaktsioonidest on kõige levinum elektrofiilne liitmine.
Halogeenimine
Kuna alküünmolekulide kolmikside koosneb ühest tugevamast sigma- ja kahest nõrgemast pi-sidemest, on nad võimelised siduma kas ühe või kaks halogeenmolekuli. Kahe halogeenmolekuli lisamine ühe alküünmolekuliga toimub elektrofiilse mehhanismi kaudu järjestikku kahes etapis:
Hüdrohalogeenimine
Vesinikhalogeniidi molekulide lisamine toimub samuti elektrofiilse mehhanismi kaudu ja kahes etapis. Mõlemas etapis toimub ühinemine Markovnikovi reeglite kohaselt:
Niisutus
Vee lisamine alküünidele toimub rutisoolade juuresolekul happelises keskkonnas ja seda nimetatakse Kucherovi reaktsiooniks.
Hüdratsiooni tulemusena tekib atsetüleenile vee lisamisel atseetaldehüüd (äädikhappe aldehüüd):
Atsetüleeni homoloogide puhul põhjustab vee lisamine ketoonide moodustumist:
Alküünide hüdrogeenimine
Alküünid reageerivad vesinikuga kahes etapis. Katalüsaatoritena kasutatakse metalle nagu plaatina, pallaadium ja nikkel:
Alküünide trimmeriseerimine
Kui atsetüleeni juhitakse kõrgel temperatuuril üle aktiivsöe, moodustub sellest mitmesuguste toodete segu, millest peamine on benseen, atsetüleeni trimerisaadus:
Alküünide dimerisatsioon
Atsetüleen läbib ka dimerisatsioonireaktsiooni. Protsess toimub katalüsaatoritena vasesoolade juuresolekul:
Alküünide oksüdatsioon
Alküünid põlevad hapnikus:
C nH 2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O
Alküünide reaktsioon alustega
Alküünid, mille molekuli lõpus on kolmik C≡C, on erinevalt teistest alküünidest võimelised astuma reaktsioonidesse, mille käigus kolmiksideme vesinikuaatom asendatakse metalliga. Näiteks atsetüleen reageerib vedelas ammoniaagis naatriumamiidiga:
HC≡CH + NaNH2 → NaC≡CNa + 2NH3,
ja ka hõbeoksiidi ammoniaagilahusega, moodustades lahustumatuid soolataolisi aineid, mida nimetatakse atsetüleniidideks:
Tänu sellele reaktsioonile on võimalik ära tunda terminaalse kolmiksidemega alküüne, samuti isoleerida selline alküün segust teiste alküünidega.
Tuleb märkida, et kõik hõbeda ja vase atsetüleniidid on plahvatusohtlikud ained.
Atsetüleniidid on võimelised reageerima halogeeni derivaatidega, mida kasutatakse keerukamate kolmiksidemega orgaaniliste ühendite sünteesil:
CH3 -C≡CH + NaNH2 → CH3 -C≡CNa + NH3
CH3-C≡CNa + CH3Br → CH3-C≡C-CH3 + NaBr
Aromaatsete süsivesinike keemilised omadused
Sideme aromaatne olemus mõjutab benseenide ja teiste aromaatsete süsivesinike keemilisi omadusi.
Ühtne 6pi elektronide süsteem on palju stabiilsem kui tavalised pi-sidemed. Seetõttu on aromaatsete süsivesinike jaoks tüüpilisemad asendusreaktsioonid kui liitumisreaktsioonid. Areenid läbivad elektrofiilse mehhanismi kaudu asendusreaktsioone.
Asendusreaktsioonid
Halogeenimine
Nitreerimine
Nitreerimisreaktsioon kulgeb kõige paremini mitte puhta lämmastikhappe, vaid selle segu kontsentreeritud väävelhappega, nn nitreerimissegu mõjul:
Alküleerimine
Reaktsioon, mille käigus üks aromaatse ringi vesinikuaatomitest asendatakse süsivesinikradikaaliga:
Halogeenitud alkaanide asemel võib kasutada ka alkeene. Katalüsaatoritena võib kasutada alumiiniumhalogeniide, raudhalogeniide või anorgaanilisi happeid.<
Lisamisreaktsioonid
Hüdrogeenimine
Kloori lisamine
Intensiivsel ultraviolettkiirgusega kiiritamisel toimib radikaalse mehhanismi kaudu:
Sarnane reaktsioon võib toimuda ainult klooriga.
Oksüdatsioonireaktsioonid
Põlemine
2C6H6 + 15O2 = 12CO2 + 6H2O + Q
Mittetäielik oksüdatsioon
Benseenitsükkel on vastupidav oksüdeerivatele ainetele nagu KMnO 4 ja K 2 Cr 2 O 7 . Reaktsiooni pole.
Benseenitsükli asendajad jagunevad kahte tüüpi:
Vaatleme benseeni homoloogide keemilisi omadusi, kasutades näitena tolueeni.
Tolueeni keemilised omadused
Halogeenimine
Tolueeni molekuli võib pidada benseeni ja metaani molekulide fragmentidest koosnevaks. Seetõttu on loogiline eeldada, et tolueeni keemilised omadused peaksid mingil määral ühendama nende kahe aine keemilised omadused eraldi võetuna. Seda täheldatakse sageli selle halogeenimise ajal. Teame juba, et benseen läbib elektrofiilse mehhanismi kaudu klooriga asendusreaktsiooni ja selle reaktsiooni läbiviimiseks on vaja kasutada katalüsaatoreid (alumiinium- või raudhalogeniide). Samal ajal on metaan võimeline reageerima ka klooriga, kuid vabade radikaalide mehhanismi kaudu, mis nõuab esialgse reaktsioonisegu kiiritamist UV-valgusega. Sõltuvalt kloorimise tingimustest võib tolueen anda benseenitsüklis kas vesinikuaatomite asendusprodukte - selleks peate kasutama samu tingimusi, mis benseeni kloorimisel, või vesiniku asendusprodukte. metüülradikaali aatomid, kui on, siis kuidas kloor mõjutab metaani ultraviolettkiirguse all:
Nagu näete, andis tolueeni kloorimine alumiiniumkloriidi juuresolekul kahe erineva produkti - orto- ja paraklorotolueeni. See on tingitud asjaolust, et metüülradikaal on esimest tüüpi asendaja.
Kui tolueeni kloorimine AlCl3 juuresolekul viiakse läbi kloori liiases koguses, on võimalik trikloroasendatud tolueeni moodustumine:
Samamoodi, kui tolueeni klooritakse valguses kõrgema kloori/tolueeni suhtega, võib saada diklorometüülbenseeni või triklorometüülbenseeni:
Nitreerimine
Vesinikuaatomite asendamine nitrorühmaga tolueeni nitreerimisel kontsentreeritud lämmastik- ja väävelhapete seguga põhjustab asendusprodukte pigem aromaatses ringis kui metüülradikaalis:
Alküleerimine
Nagu juba mainitud, on metüülradikaal esimest tüüpi orienteeriv aine, mistõttu selle alküülimine Friedel-Craftsi järgi viib asendusproduktideni orto- ja para-asendis:
Lisamisreaktsioonid
Tolueeni saab hüdrogeenida metüültsükloheksaaniks, kasutades metallkatalüsaatoreid (Pt, Pd, Ni):
C6H5CH3 + 9O2 → 7CO2 + 4H2O
Mittetäielik oksüdatsioon
Oksüdeeriva ainega, näiteks kaaliumpermanganaadi vesilahusega kokkupuutel külgahel oksüdeerub. Aromaatne tuum ei saa sellistes tingimustes oksüdeeruda. Sel juhul moodustub olenevalt lahuse pH-st kas karboksüülhape või selle sool.