الخاصية الرئيسية للبروتين التي تضمن وظيفته هي التفاعل الانتقائي مع مادة معينة - يجند.
يمكن أن تكون الروابط عبارة عن مواد ذات طبيعة مختلفة ، سواء كانت مركبات ذات وزن جزيئي منخفض أو جزيئات كبيرة ، بما في ذلك البروتينات. توجد على جزيئات البروتين مواقع ترتبط بها الرابطة - مراكز ربط أو مراكز نشطة. تتشكل مراكز التجليد من بقايا الأحماض الأمينية المجمعة نتيجة لتشكيل الهياكل الثانوية والثالثية.
يمكن أن تكون الروابط بين البروتين والرابط غير تساهمية أو تساهمية. يتم توفير الخصوصية العالية للتفاعل ("التعرف") للبروتين والرابط من خلال تكامل بنية مركز الربط مع التركيب المكاني للرابط.
يُفهم التكامل على أنه المراسلات الكيميائية والمكانية بين المركز النشط للبروتين والرابط. يتم وصف التفاعل بين البروتين P و ligand L بالمعادلة:
بروتين + مركب يجند بروتين يجند.
1. الخصائص الفيزيائية والكيميائية الرئيسية للبروتينات هي الوزن الجزيئي والشحنة الكهربائية والذوبان في الماء. يمكن أن يختلف الوزن الجزيئي للبروتينات بشكل كبير. على سبيل المثال ، يبلغ الوزن الجزيئي لهرمون الأنسولين حوالي 6 آلاف دا ، بينما يبلغ الوزن الجزيئي للغلوبولين المناعي M حوالي مليون دا. يعتمد الوزن الجزيئي للبروتين على عدد بقايا الأحماض الأمينية التي تشكل تركيبته ، بالإضافة إلى كتلة مكونات الأحماض غير الأمينية. يبلغ متوسط كتلة بقايا حمض أميني واحد 110 دا. وهكذا ، بمعرفة عدد بقايا الأحماض الأمينية في البروتين ، يمكن للمرء أن يقدر وزنه الجزيئي والعكس صحيح (N.N. Mushkambarov ، 1995). يتم تحديد الشحنة الكهربائية للبروتين من خلال نسبة المجموعات الموجبة والسالبة الشحنة على سطح جزيئه. تعتمد شحنة جزيء البروتين على درجة الحموضة في الوسط. يستخدم مفهوم "النقطة الكهربية" لوصف البروتين. النقطة الكهروضوئية (pI) - قيمة الأس الهيدروجيني للوسط الذي تكون فيه الشحنة الكلية لجزيء البروتين صفرًا. عند النقطة الكهربية ، تكون البروتينات هي الأقل ثباتًا في المحلول وتتسرب بسهولة. تعتمد قيمة pI على نسبة الأحماض الأمينية الحمضية والأساسية في البروتين. بالنسبة للبروتينات والببتيدات مع غلبة الأحماض الأمينية الحمضية (سالبة الشحنة عند درجة الحموضة 7.0) ، تكون قيمة pI في بيئة حمضية ؛ بالنسبة للبروتينات والببتيدات مع غلبة الأحماض الأمينية الأساسية (شحنة موجبة عند درجة الحموضة 7.0) ، تكون قيمة pI في بيئة حمضية. النقطة الكهربية هي ثابت مميز للبروتينات ، وتتراوح قيمته بالنسبة لمعظم بروتينات الأنسجة الحيوانية من 5.5 إلى 7.0 ، مما يشير إلى غلبة الأحماض الأمينية الحمضية في تكوينها. ومع ذلك ، توجد في الطبيعة بروتينات تكمن قيمة نقطة تساوي الطاقة الكهربية في قيم الأس الهيدروجيني القصوى للوسط. على وجه الخصوص ، فإن قيمة pI للبيبسين (إنزيم عصير المعدة) هي 1 ، وقيمة الليزوزيم (إنزيم يكسر جدار الخلية للكائنات الدقيقة) حوالي 11. الوزن الجزيئي وقيم نقطة التكافؤ الكهربية لبعض البروتينات موضحة في الجدول 1.4. الجدول 1.4 بعض ثوابت بلازما الدم وبروتينات الأنسجة
ذوبان البروتينات في الماء.من مسار الكيمياء الفيزيائية الحيوية ، من المعروف أن البروتينات ، كمركبات جزيئية عالية ، تشكل محاليل غروانية. يتم تحديد استقرار محاليل البروتين في الماء من خلال العوامل التالية:
ضع في اعتبارك أنه تحت تأثير العوامل الفيزيائية والكيميائية المختلفة ، يمكن أن يحدث ترسيب البروتينات من المحاليل الغروانية. يميز:
لاحظ أن الآليات التالية قد تكمن وراء تفاعلات ترسيب البروتين:
في أغلب الأحيان ، يتميز عمل العوامل المسببة لتساقط البروتين بمزيج من اثنين أو كل هذه الآليات الثلاثة. النشاط البيولوجي. يعتمد عمل أي بروتين على قدرته على التفاعل بشكل انتقائي مع الجزيئات أو الأيونات المحددة بدقة - الروابط. على سبيل المثال ، بالنسبة للإنزيمات التي تحفز التفاعلات الكيميائية ، ستكون الروابط عبارة عن مواد تشارك في هذه التفاعلات (ركائز) ، بالإضافة إلى العوامل المساعدة والمنشطات والمثبطات. بالنسبة لبروتينات النقل ، فإن الروابط هي المواد المنقولة ، وما إلى ذلك. يستطيع اللجند التفاعل مع موقع معين لجزيء البروتين - مركز الربط أو المركز النشط. يتكون هذا المركز من جذور الأحماض الأمينية القريبة مكانياً على مستوى البنية الثلاثية للبروتين. ترجع قدرة ligand على التفاعل مع مركز الربط إلى تكاملها ، أي التكامل المتبادل لبنيتها المكانية (على غرار تفاعل "key-lock"). تتشكل الروابط غير التساهمية (هيدروجين ، أيوني ، كاره للماء) بين المجموعات الوظيفية للرابط وموقع الربط. يمكن أن يفسر تكامل ligand وموقع الارتباط الخصوصية العالية (الانتقائية) لتفاعل البروتين الرابط. لذلك ، تختلف البروتينات المختلفة عن بعضها البعض في خصائصها الفيزيائية والكيميائية ونشاطها البيولوجي. تعتمد طرق فصل مخاليط البروتين إلى أجزاء وعزل البروتينات الأنزيمية الفردية على هذه الاختلافات. تستخدم هذه الأساليب على نطاق واسع في الكيمياء الحيوية الطبية والتكنولوجيا الحيوية. 2. تمسخ البروتين- هذا تغيير في الخصائص الفيزيائية والكيميائية الأصلية (الطبيعية) ، والأهم من ذلك ، الخصائص البيولوجية للبروتين بسبب انتهاك بنيته الرباعية والثالثية وحتى الثانوية. يمكن أن يحدث تمسخ البروتين بسبب:
تتميز البروتينات المشوهة بما يلي:
يرجى ملاحظة أنه في ظل ظروف معينة ، من الممكن استعادة تكوين البروتين الأصلي (الأصلي) بعد إزالة العامل الذي تسبب في التمسخ. هذه العملية تسمى التجديد. تذكر بعض الأمثلة على استخدام عملية تمسخ البروتين في الطب:
|
4 (1). الهيموغلوبين هو بروتين خيفي. التغييرات التوافقية في جزيء الهيموجلوبين. تأثير تعاوني. منظمات تقارب الهيموغلوبين للأكسجين. الاختلافات الهيكلية والوظيفية بين الميوجلوبين والهيموجلوبين.
الهيموجلوبين: بروتين خيفي
كان الانتقال التطوري من الميوغلوبين الأحادي إلى الهيموغلوبين الرباعي مصحوبًا بظهور خصائص جديدة. جزيء الهيموجلوبين أكثر تعقيدًا من جزيء الميوجلوبين. بادئ ذي بدء ، الهيموغلوبين ، بالإضافة إلى 0 2 ، ينقل H + و CO 2. ثانيًا ، يتم تنظيم ارتباط الأكسجين بواسطة الهيموجلوبين بمكونات محددة من البيئة الداخلية ، وهي H + و CO 2 ومركبات الفوسفور العضوية. هذه المنظمات لها تأثير قوي على قدرة الهيموغلوبين على الارتباط بالأكسجين ، على الرغم من حقيقة أنها ترتبط بالبروتين في مواقع بعيدة عن الهيم. بشكل عام ، ما يسمى ب تفاعل خيفيأولئك. يحدث التفاعل بين المناطق المنفصلة مكانيًا في العديد من البروتينات. تلعب التأثيرات الخيفية دورًا أساسيًا في تنظيم وتكامل العمليات الجزيئية في الأنظمة البيولوجية. الهيموغلوبين هو البروتين الخيفي الأكثر دراسة ، وبالتالي فمن المنطقي النظر في هيكله ووظيفته بمزيد من التفصيل.
التغييرات المعيارية في الهيموغلوبين
يرتبط ارتباط الأكسجين بتمزق الملح
السندات التي شكلتها مجموعات الكربوكسيل الطرفية
الوحدات الفرعية (الشكل 7) وهذا يسهل ارتباط الجزيئات التالية
الأكسجين ، لأنه يتطلب كسر رقم أصغر
روابط الملح. هذه التغييرات لها تأثير كبير على
البنية الثانوية والثالثية وخاصة الرباعية
الهيموغلوبين. في هذه الحالة ، يتحول زوج واحد من الوحدات الفرعية A / B
فيما يتعلق بزوج A / B آخر ، مما يؤدي إلى الضغط
tetramer وزيادة تقارب الهيم للأكسجين (الشكلان 8 و 9).
التغييرات المعيارية في بيئة HEMOGROUP
يترافق أكسجين الهيموغلوبين مع بنيوي
التغييرات في بيئة الهيموغروب. عندما تتأكسد الذرة
الحديد ، والذي برز في deoxyhemoglobin 0.06 نانومتر من
مستوى حلقة الهيم ، يرسم إلى هذا المستوى (الشكل.
عشرة). بعد ذرة الحديد ، يقترب من الهيم
الهيستيدين القريب (F8) ، وكذلك المجاورة له
يمكن أن يكون جزيء الهيموغلوبين في شكلين - متوتر ومرتاح. يميل الشكل المريح من الهيموجلوبين إلى التشبع بالأكسجين بمعدل 70 مرة أسرع من الشكل المتوتر. إن التغير في كسور الأشكال المتوترة والمسترخية في الكمية الإجمالية للهيموغلوبين في الدم يحدد الشكل S على شكل منحنى تفكك أوكسي هيموغلوبين ، وبالتالي ما يسمى تقارب الهيموغلوبين للأكسجين. إذا كان احتمال الانتقال من شكل متوتر من الهيموغلوبين إلى شكل مسترخٍ أكبر ، فإن ألفة الهيموغلوبين للأكسجين تزداد ، والعكس صحيح. يتغير احتمال تكوين كسور الهيموجلوبين لأعلى أو لأسفل تحت تأثير عدة عوامل. العامل الرئيسي هو ارتباط الأكسجين بمجموعة الهيم لجزيء الهيموجلوبين. في الوقت نفسه ، كلما زاد عدد مجموعات الهيموجلوبين من الهيموجلوبين التي تربط الأكسجين في كريات الدم الحمراء ، كلما أصبح انتقال جزيء الهيموجلوبين إلى شكل مسترخٍ أسهل ، وكلما زاد تقاربهم للأكسجين. لذلك ، عند انخفاض P02 ، الذي يحدث في الأنسجة النشطة الأيضية ، يكون تقارب الهيموغلوبين للأكسجين أقل ، وعند ارتفاع P02 يكون أعلى. بمجرد أن يلتقط الهيموجلوبين الأكسجين ، تزداد تقاربه للأكسجين ويصبح جزيء الهيموجلوبين مشبعًا عندما يرتبط بأربعة جزيئات أكسجين. عندما تصل كريات الدم الحمراء التي تحتوي على الهيموجلوبين إلى الأنسجة ، ينتشر الأكسجين من كريات الدم الحمراء في الخلايا. في العضلات ، يدخل نوعًا من مستودع الأكسجين - في جزيئات الميوجلوبين ، حيث يستخدم الأكسجين في الأكسدة البيولوجية للعضلات. انتشار الأكسجين من الهيموغلوبين في خلايا الدم الحمراء في الأنسجة يرجع إلى انخفاض P02 في الأنسجة - 35 ملم زئبق. فن. داخل خلايا الأنسجة ، يكون توتر الأكسجين المطلوب للحفاظ على التمثيل الغذائي الطبيعي أصغر - لا يزيد عن 1 كيلو باسكال. لذلك ، يصل الأكسجين عن طريق الانتشار من الشعيرات الدموية إلى الخلايا النشطة الأيضية. تتكيف بعض الأنسجة مع المحتوى المنخفض من PO2 في الشعيرات الدموية ، والذي يتم تعويضه عن طريق الكثافة العالية للشعيرات الدموية لكل وحدة حجم من الأنسجة. على سبيل المثال ، في عضلات الهيكل العظمي والقلب ، يمكن أن تنخفض الشعيرات الدموية P02 بسرعة كبيرة أثناء الانقباض. تحتوي خلايا العضلات على بروتين الميوغلوبين ، الذي له تقارب أعلى للأكسجين من الهيموغلوبين. الميوجلوبين مشبع بشكل مكثف بالأكسجين ويعزز انتشاره من الدم إلى عضلات الهيكل العظمي والقلب ، حيث يسبب عمليات الأكسدة البيولوجية. هذه الأنسجة قادرة على استخراج ما يصل إلى 70٪ من الأكسجين من الدم الذي يمر عبرها ، ويرجع ذلك إلى انخفاض تقارب الهيموجلوبين للأكسجين تحت تأثير درجة حرارة الأنسجة ودرجة الحموضة. تأثير درجة الحموضة ودرجة الحرارة على ألفة الهيموجلوبين للأكسجين. جزيئات الهيموغلوبين قادرة على التفاعل مع أيونات الهيدروجين ، ونتيجة لهذا التفاعل يحدث انخفاض في تقارب الهيموغلوبين للأكسجين. عندما يكون تشبع الهيموغلوبين أقل من 100٪ ، يقلل الرقم الهيدروجيني المنخفض ارتباط الأكسجين بالهيموغلوبين - ينتقل منحنى تفكك أوكسي هيموغلوبين إلى اليمين على طول المحور السيني. يسمى هذا التغيير في خصائص الهيموغلوبين تحت تأثير أيونات الهيدروجين تأثير بور. تنتج الأنسجة النشطة الأيضية أحماض مثل حمض اللاكتيك وثاني أكسيد الكربون. إذا انخفض الرقم الهيدروجيني لبلازما الدم من 7.4 إلى 7.2 الطبيعي ، والذي يحدث أثناء تقلص العضلات ، فإن تركيز الأكسجين فيها سيزداد بسبب تأثير بوهر. على سبيل المثال ، عند درجة حموضة ثابتة تبلغ 7.4 ، سيتخلى الدم عن 45٪ أكسجين ، أي أن تشبع الهيموجلوبين بالأكسجين سينخفض إلى 55٪. ومع ذلك ، عندما ينخفض الأس الهيدروجيني إلى 7.2 ، يتحول منحنى التفكك على طول المحور السيني إلى اليمين. نتيجة لذلك ، ينخفض تشبع الهيموجلوبين بالأكسجين إلى 40٪ ، أي أن الدم يمكن أن يعطي ما يصل إلى 60٪ من الأكسجين في الأنسجة ، وهو ما يزيد بمقدار 1/3 عن الرقم الهيدروجيني الثابت. تزيد الأنسجة النشطة الأيضية من إنتاج الحرارة. تؤدي الزيادة في درجة حرارة الأنسجة أثناء العمل البدني إلى تغيير نسبة كسور الهيموغلوبين في كريات الدم الحمراء وتسبب تحولًا في منحنى تفكك أوكسي هيموغلوبين إلى اليمين على طول المحور x. نتيجة لذلك ، سيتم إطلاق المزيد من الأكسجين من الهيموجلوبين في كريات الدم الحمراء ويدخل إلى الأنسجة. تأثير 2،3-diphosphoglycerate (2،3-DPG) على ألفة الهيموجلوبين للأكسجين. في ظل ظروف فسيولوجية معينة ، على سبيل المثال ، عندما ينخفض P02 في الدم إلى ما دون المستوى الطبيعي (نقص الأكسجة) نتيجة لوجود شخص على ارتفاع عالٍ فوق مستوى سطح البحر ، يصبح إمداد الأنسجة بالأكسجين غير كافٍ. أثناء نقص الأكسجة ، قد تنخفض ألفة الهيموجلوبين للأكسجين بسبب زيادة محتوى 2،3-DPG في كريات الدم الحمراء. على عكس تأثير بوهر ، فإن الانخفاض في تقارب الهيموجلوبين للأكسجين تحت تأثير 2،3-دي بي جي لا يمكن عكسه في الشعيرات الدموية في الرئتين. ومع ذلك ، عندما يتحرك الدم عبر الشعيرات الدموية في الرئتين ، يكون تأثير 2،3-DPG على تقليل تكوين أوكسي هيموغلوبين في كريات الدم الحمراء (الجزء المسطح من منحنى تفكك أوكسي هيموغلوبين) أقل وضوحًا من إطلاق الأكسجين تحت تأثير 2،3-DPG في الأنسجة (جزء منحدر من المنحنى) ، مما يوفر إمدادات الأكسجين الطبيعية للأنسجة
تم إنشاء الهيكل الأصلي ثلاثي الأبعاد نتيجة لعمل عدد من عوامل الطاقة والانتروبيا. ينعكس أيضًا التغيير في الحالة التوافقية لجزيء البروتين بسبب التأثيرات الخارجية المختلفة (الأس الهيدروجيني ودرجة الحرارة والتركيب الأيوني) في نشاطه الوظيفي. تحدث عمليات إعادة الترتيب التوافقية بسرعة كبيرة. في المراحل الأولى ، يكون لديهم طابع شكلي محلي ، مما يتسبب في إزاحة المجموعات الذرية الفردية فقط. سيؤدي انتشار مثل هذه النزوح المحلي إلى مناطق أخرى من بنية الجزيئات الكبيرة بالفعل إلى تغيير توافق عام في جزيء البوليمر الحيوي.
الميوغلوبين- يتكون من سلسلة بولي ببتيد واحدة ، بما في ذلك 153 من بقايا الأحماض الأمينية ، ومجموعة بورفيرين الحديد (الهيم) لكل جزيء. يشير الميوغلوبين إلى البروتينات الدموية التي يمكنها ربط الأكسجين بشكل عكسي ؛ في خلايا العضلات الهيكلية ، فهي مسؤولة عن حجز الأكسجين ، وكذلك عن زيادة معدل انتشاره عبر الخلايا. من الناحية التطورية ، الميوغلوبين هو مقدمة الهيموغلوبين. لا يحتوي الجزيء على روابط ثاني كبريتيد ويتميز بأنه حلزوني بنسبة 77٪. يقع الهيم المسؤول عن ارتباط الأكسجين في "جيب مسعور" يتكون من أحماض أمينية خاصة مخصصة لهذا الغرض. Heme عبارة عن حلقة كبيرة من البروتوبورفيرين مع أيون حديدوز مرتبط بشكل منسق يقع في وسط الجزيء. هذا التثبيت المكاني للهيم يجعل من الممكن ربط جزيء الأكسجين كالرابط السادس.
الهيموغلوبين- بروتين الدم "التنفسي". ينقل الأكسجين عبر الجهاز الدوري للرئتين إلى الأعضاء ومراكز الاستهلاك الأخرى. يتكون جزيء الهيموجلوبين من أربع سلاسل متطابقة من البولي ببتيد ، كل منها يحمل الهيم. تسمى سلاسل عديد الببتيد للهيموجلوبين أ و ب , ويتم كتابة التركيب المتماثل للجزيء على هيئة أ 2 ب 2 . يتم تشكيل هيكل رباعي من خلال تفاعلات كارهة للماء بين سلاسل البولي ببتيد الفردية. عند إضافة الأكسجين إلى الهيم ، يتم تكوين أوكسي هيموغلوبين ، يختلف هيكله الرباعي قليلاً فقط عن الشكل غير المؤكسج.
تؤدي إضافة الأكسجين إلى حدوث عدد من التغييرات التوافقية في جزيء Hb. يرتبط ارتباط الأكسجين بنقل أيون Fe 2+ إلى حالة الدوران المنخفض بإزاحة متزامنة للحديد في مستوى مجموعة الهيم. هناك تمزق تدريجي لجسور الملح بين الوحدات الفرعية. تزداد المسافة بين نصفي الوحدات الفرعية a ، ويتم تقليل المسافة بين نصفي الوحدات الفرعية b. بشكل عام ، يحول الأوكسجين كل من الوحدات الفرعية من مطابقة deoxy و Oxy. يساهم تمزق أربعة جسور ملح من أصل ستة أثناء أكسجة أول وحدتين فرعيتين في تمزق الجسرين الآخرين ، وبالتالي ، يسهل ربط جزيئات الأكسجين التالية بالوحدات الفرعية المتبقية ، مما يزيد من تقاربها مع الأكسجين عن طريق عدة مئات من المرات. هذه هي الطبيعة التعاونية للانضمام.
5 (1). الهياكل الأولية والثانوية للحمض النووي. قواعد Chargaff. مبدأ التكامل. أنواع الروابط في جزيء الحمض النووي. الدور البيولوجي للحمض النووي. الأمراض الجزيئية هي نتيجة الطفرات الجينية.
الهيكل الأساسي للحمض النووي -ترتيب تناوب أحادي فوسفات الديوكسي ريبونوكليوزيد (dNMP) في سلسلة عديد النوكليوتيدات.
تشارك كل مجموعة فوسفات في سلسلة عديد النوكليوتيد ، باستثناء بقايا الفوسفور عند نهاية 5 "من الجزيء ، في تكوين رابطتين استر يشتملان على 3" - و 5 "ذرات كربون من اثنين من الديوكسيريبوز المتجاورين ، وبالتالي فإن يتم الإشارة إلى الرابطة بين المونومرات بواسطة 3 "، 5" - phosphodiester.
تتميز النيوكليوتيدات الطرفية للحمض النووي بالهيكل: في الطرف 5 "توجد مجموعة فوسفات ، وفي الطرف 3" من السلسلة توجد مجموعة OH حرة. تسمى هذه الغايات نهايات 5 "و 3". عادةً ما يتم اختصار التسلسل الخطي للنيوكليوتيدات غير المؤكدة في سلسلة بوليمر الحمض النووي باستخدام رمز من حرف واحد ، على سبيل المثال -A-G-C-T-T-A-C-A- من 5 "- إلى 3" - نهاية.
يحتوي كل مونومر حمض نووي على بقايا حمض الفوسفوريك. عند درجة الحموضة 7 ، تتأين مجموعة الفوسفات بالكامل ، لذلك في الجسم الحيتوجد الأحماض النووية على شكل polyanions (لها شحنة سالبة متعددة). تظهر بقايا البنتوز أيضًا خصائص محبة للماء. القواعد النيتروجينية تكاد تكون غير قابلة للذوبان في الماء ، لكن بعض ذرات حلقات البيورين والبيريميدين يمكن أن تتشكل روابط هيدروجينية.
التركيب الثانوي للحمض النووي.في عام 1953 ، اقترح J. Watson و F. Crick نموذجًا للبنية المكانية للحمض النووي. وفقًا لهذا النموذج ، يكون لجزيء الحمض النووي شكل حلزون يتكون من سلسلتين من عديد النوكليوتيد ملتويتين بالنسبة لبعضهما البعض وحول محور مشترك. الحلزون المزدوج أيمنسلسلة عديد النوكليوتيد فيه مضاد(الشكل 4-6) ، أي إذا كان أحدهم موجهًا في الاتجاه 3 "→ 5" ، فسيكون الثاني موجهًا في الاتجاه 5 "→ 3". لذلك ، في كل نهاية
أرز. 4-6. الحلزون المزدوج للحمض النووي.تتكون جزيئات الحمض النووي من خيطين متعارضين مع تسلسل نوكبيوتيد مكمل. السلاسل ملتوية بالنسبة لبعضها البعض في الحلزون الأيمن بحيث يكون هناك ما يقرب من 10 أزواج أساسية لكل دور.
توجد جزيئات الحمض النووي في الطرف الخامس من الخيط الواحد والطرف الثالث من الخيط الآخر.
تقع جميع قواعد سلاسل الحمض النووي داخل الحلزون المزدوج ، ويوجد العمود الفقري لفوسفات البنتوز بالخارج. يتم الاحتفاظ بسلاسل البولينيوكليوتيد بالنسبة لبعضها البعض بسبب الروابط الهيدروجينية بين البيورين التكميلي وقواعد بيريميدين النيتروجينية A و T (رابطان) وبين G و C (ثلاث روابط) (الشكل 4-7). مع هذه المجموعة ، كل
أرز. 4-7. أزواج قاعدة البيورين-بيريميدين في الحمض النووي.
يحتوي الزوج على ثلاث حلقات ، وبالتالي فإن الحجم الإجمالي لأزواج القواعد هذه هو نفسه على طول الجزيء بأكمله. الروابط الهيدروجينية مع مجموعات أخرى من القواعد في زوج ممكنة ، لكنها أضعف بكثير. إن تسلسل النوكليوتيدات لسلسلة واحدة مكمل تمامًا لتسلسل النوكليوتيدات في السلسلة الثانية. لذلك ، وفقًا لقاعدة Chargaff (أنشأ Erwin Chargaff في عام 1951 أنماطًا في نسبة قواعد البيورين والبيريميدين في جزيء DNA) ، فإن عدد قواعد البيورين (A + G) يساوي عدد قواعد بيريميدين (T + C ).
القواعد التكميلية مكدسة في قلب اللولب. بين قواعد جزيء مزدوج تقطعت به السبل في كومة ، التفاعلات الطاردة للماء،استقرار اللولب المزدوج.
يستثني مثل هذا الهيكل ملامسة المخلفات النيتروجينية بالماء ، ولكن لا يمكن أن تكون الكومة الأساسية رأسية تمامًا. يتم إزاحة الأزواج الأساسية قليلاً عن بعضها البعض. في الهيكل المُشكّل ، يتم تمييز اثنين من الأخاديد - واحدة كبيرة ، بعرض 2.2 نانومتر ، وواحدة صغيرة ، بعرض 1.2 نانومتر. تتفاعل القواعد النيتروجينية في منطقة الأخاديد الرئيسية والثانوية مع بروتينات معينة تشارك في تنظيم بنية الكروماتين.
قواعد Chargaff- نظام من القواعد المحددة تجريبياً التي تصف العلاقات الكمية بين أنواع مختلفة من القواعد النيتروجينية في الحمض النووي. تمت صياغتها نتيجة لعمل مجموعة من عالم الكيمياء الحيوية إروين تشارجاف في 1949-1951.
قبل عمل مجموعة Chargaff ، سيطرت ما يسمى بنظرية “tetranucleotide” ، والتي وفقًا لها يتكون الحمض النووي من كتل متكررة من أربع قواعد نيتروجينية مختلفة (الأدينين ، الثايمين ، الجوانين والسيتوزين). تمكن Chargaff وزملاؤه من فصل نيوكليوتيدات الحمض النووي باستخدام كروماتوغرافيا الورق وتحديد النسب الكمية الدقيقة لأنواع مختلفة من النيوكليوتيدات. لقد اختلفوا بشكل كبير عن تلك المتساوية التي يمكن توقعها إذا تم تمثيل جميع القواعد الأربعة بنسب متساوية. كانت العلاقات التي حددها Chargaff للأدينين (A) والثيمين (T) والجوانين (G) والسيتوزين (C) كما يلي:
1. كمية الأدينين تساوي كمية الثايمين ، والجوانين يساوي السيتوزين: A = T ، G = C.
2. عدد البيورينات يساوي عدد البيريميدينات: A + G = T + C.
3. عدد القواعد مع المجموعات الأمينية في الموضع 6 يساوي عدد القواعد مع مجموعات كيتو في الموضع 6: A + C = G + T.
في الوقت نفسه ، قد تختلف النسبة (A + T) :( G + C) في الحمض النووي للأنواع المختلفة. في بعض أزواج AT تسود ، في البعض الآخر - HC.
لعبت قواعد Chargaff ، جنبًا إلى جنب مع بيانات حيود الأشعة السينية ، دورًا حاسمًا في فك تشفير بنية الحمض النووي بواسطة J. Watson و Francis Crick.
التكامل(في كيمياء, البيولوجيا الجزيئيةو علم الوراثة) - المراسلات المتبادلة للجزيئات البوليمرات الحيويةأو شظاياها ، مما يضمن تكوين روابط بين الأجزاء التكميلية المكانية (التكميلية) من الجزيئات أو شظاياها الهيكلية بسبب التفاعلات فوق الجزيئية(تكوين روابط هيدروجينية ، تفاعلات كارهة للماء ، تفاعلات كهروستاتيكية لمجموعات وظيفية مشحونة ، إلخ).
لا يترافق تفاعل الأجزاء التكميلية أو البوليمرات الحيوية مع تكوين تساهمية رابطة كيميائيةبين الأجزاء التكميلية ، ومع ذلك ، بسبب المراسلات المكانية المتبادلة للشظايا التكميلية ، فإنه يؤدي إلى تكوين العديد من الروابط الضعيفة نسبيًا (الهيدروجين وفان دير فال) مع طاقة كلية كبيرة بما يكفي ، مما يؤدي إلى تكوين مجمعات جزيئية مستقرة.
في الوقت نفسه ، تجدر الإشارة إلى أن آلية النشاط التحفيزي للإنزيمات يتم تحديدها من خلال تكامل الإنزيم والحالة الانتقالية أو المنتج الوسيط للتفاعل المحفز - وفي هذه الحالة ، يمكن للتكوين القابل للانعكاس للرابطة الكيميائية تحدث.
تكامل الحمض النووي
متي احماض نووية- كلا من القواعد النيتروجينية قليلة النوكليوتيد وعديد النوكليوتيد النيوكليوتيداتقادر بسبب التعليم روابط هيدروجينيةتشكل مجمعات مقترنة الأدينين-الثايمين(أو اليوراسيلفي RNA) و جوانين-السيتوزينعندما تتفاعل السلاسل احماض نووية. يلعب هذا التفاعل دورًا رئيسيًا في عدد من العمليات الأساسية لتخزين ونقل المعلومات الجينية: تكرار الحمض النوويالذي يضمن نقل المعلومات الجينية أثناء انقسام الخلية ، النسخ DNA إلى RNA أثناء التوليف البروتينات، مشفر بواسطة DNA الجين، تخزين المعلومات الجينية في عمليات إصلاح الحمض النووي والحمض النووي مزدوج الشريطة عند تلفها.
يستخدم مبدأ التكامل في تخليق الحمض النووي. هذا تناظر صارم لمركب القواعد النيتروجينية المتصلة بواسطة روابط هيدروجينية ، حيث: A-T ( الأدينينيربط مع ثيمين) جي سي ( جوانينيربط مع سيتوزين)
التحفيز الأنزيمي
يعتبر ارتباط الركيزة الإنزيمية التكميلي عاملاً رئيسيًا في آلية النشاط الأنزيمي ، وعلى عكس المواقف الموضحة أعلاه مع تكوين مجمعات غير مرتبطة كيميائيًا ، يمكن أن يؤدي إلى بدء تفاعل كيميائي - في حالة وجود رابطة إنزيممع الركيزة ، يكون التكامل منخفضًا نسبيًا ، ومع ذلك ، مع التكامل العالي لحالة تفاعل الانتقال للركيزة ، يتم تثبيت هذه الحالة ، مما يؤدي إلى تأثير النشاط التحفيزي للأنزيمات: مثل هذا الاستقرار للحالة الانتقالية يعادل انخفاض في طاقة التفعيلوبالتالي ، زيادة حادة في معدل التفاعل.
يعتمد عمل أي بروتين على قدرته على التفاعل الانتقائي مع مادة أخرى - يجند. يمكن أن يكون اللجند إما مادة ذات وزن جزيئي منخفض أو جزيء ضخم ، بما في ذلك بروتين آخر. يلتصق اللجند بموقع محدد على سطح جزيء البروتين - مركز الارتباط (المركز النشط).
غالبًا ما يتم توفير خصوصية التفاعل (التعرف) من خلال تكامل بنية مركز الربط مع بنية الترابط ، على غرار الطريقة التي يحدث بها أثناء التجميع الذاتي للهيموجلوبين من البروتومرات. في بعض الأحيان ، تعتمد الانتقائية بشكل أساسي على تفاعل الذرة التي يرتبط بها الترابط مباشرة. مثال على ذلك هو إضافة الأكسجين إلى ذرة حديد في الميوجلوبين أو الهيموجلوبين. ومع ذلك ، حتى في مثل هذه الحالات ، تعتمد الانتقائية إلى حد كبير على جزء البروتين في الجزيء. تعمل ذرة الحديد نفسها (كجزء من الهيم) في البروتينات الأخرى - السيتوكرومات - بطريقة مختلفة تمامًا: فهي تعمل كحامل للإلكترونات ، وتتلقىها من بعض المواد وتنقلها إلى أخرى (في هذه الحالة ، يصبح الحديد بالتناوب ثنائي التكافؤ أو ثلاثي التكافؤ).
يمكن أن تكون الروابط بين البروتين والرابط إما تساهمية أو غير تساهمية.
يشغل مركز الربط أحيانًا جزءًا صغيرًا من سطح جزيء البروتين (في الهيموجلوبين ، يكون مركز ارتباط الأكسجين هو فقط منطقة ذرة الحديد) ، وفي بعض الأحيان يحتل جزءًا كبيرًا من السطح (على سبيل المثال ، أسطح التلامس لـ بروتومرات الهيموغلوبين).
يمكن أن يحتوي جزيء البروتين على موقع واحد أو موقعين نشطين أو أكثر بنفس الخصوصية أو بخصوصية مختلفة. على سبيل المثال ، يحتوي كل بروتين هيموجلوبين على ثلاثة مواقع ربط لثلاثة بروتومرات أخرى وموقع ربط واحد للهيم. يحتوي جزيء الهيموجلوبين الرباعي على أربعة مراكز نشطة (ذرات الحديد) لربط الأكسجين.
يتكون المركز النشط من بقايا الأحماض الأمينية ، وغالبًا ما تكون متباعدة في سلسلة الببتيد. يتم جمعها في مكان واحد نتيجة لتشكيل بنية ثانوية وثالثية. لذلك ، أثناء تمسخ البروتين ، يتم تدمير المراكز النشطة وفقدان النشاط البيولوجي.يمكن ملاحظة تكوين المركب من خلال انخفاض تركيز الليجند الحر L أو زيادة تركيز مركب PL ، إذا كان تكوينه مصحوبًا بظهور أي خاصية جديدة ، على سبيل المثال ، تغيير في اللون أو امتصاص في الجزء فوق البنفسجي من الطيف. تُستخدم هذه الطريقة أيضًا في التحديد الكمي للبروتينات الفردية (انظر أدناه).
عند تركيز ثابت لـ P وتركيز متزايد لـ L ، يزداد تركيز PL على طول منحنى قطعي ، ويميل إلى الحد الأقصى عندما يكون البروتين بأكمله مرتبطًا بالرابط (منحنى التشبع). بالنسبة للبروتينات قليلة القسيمات ، قد يكون منحنى التشبع على شكل حرف S. يمكن التعبير عن درجة التشبع كنسبة مئوية من تركيز المركب من تركيز البروتين الأولي (قبل إضافة ligand) [P] 0: درجة التشبع هي (/ [P] 0) 100 (الشكل 1.29 ؛ انظر أيضا الشكل 1.26).
ويترتب على معادلة توازن التفاعل أنه إذا كان [P] = ، فإن K = [L]. تعني المساواة [P] نصف تشبع البروتين ، أي الحالة التي تكون فيها 50٪ من جزيئات البروتين مرتبطة بالرابط ، و 50٪ تبقى حرة: [P] = = 1 / بشكل ثابت ، Ktss تساوي عدديًا التركيز من يجند حيث يتحقق نصف التشبع السنجاب. على التين. يوضح الشكل 1.29 كيف يمكن تحديد K من منحنى التشبع ، وبالتالي ، يمكن تقدير ألفة ليجند للبروتين.
يجاندس - هذه هي المواد التي يمكن أن ترتبط على وجه التحديد بالمركز النشط للجزيئات في بنية معينة.
بيوليجاندس أقترح تسمية تلك الروابط التي تقوم بالتنظيم الحيوي في الكائنات الحية بسبب ارتباطها بالجزيئات المستهدفة للمستقبلات. (© Sazonov V.F. ، 2012. © kineziolog.bodhy.ru، 2012.)
الروابط في التنظيم الحيوي (bioligands) - هذه في الواقع مواد تحكم في الإشارات قادرة على إرسال أوامر التحكم بسبب ارتباطها بالمركز النشط للمستقبلات الجزيئية التي لها خصوصية بالنسبة لها.
وبالتالي ، يمكن القول أن بيوليجاندستنفيذ التنظيم الكيميائي ، بمعنى آخر. التحكم الكيميائي في الخلايا أو الكائن الحي أو أجزائه أو مجموعة من الكائنات الحية.
آلية عمل bioligands
وفقًا لتأثير الروابط على تكوين البروتين ، يمكن تقسيم تفاعلات البروتين - الترابط إلى عدة فئات.
تفاعلات الفئة الأولى:
لا يتسبب الترابط المرتبط بالبروتين في حدوث تغييرات كبيرة في التكوين ، ولكنه يعمل على استقرار بنية البروتين.
مثال على ذلك هو ربط أيونات Ca2 * بالليزوزيم. في وجود يجند (أيونات Ca2 ") ، يتطلب تغيير طبيعة الليزوزيم تركيزات كبيرة من العامل المقابل (اليوريا أو هيدروكلوريد الغوانيدين).
على ما يبدو ، في هذه الحالة ، بمساعدة Ca2< образуются дополнительные связи между радикалами.
تفاعلات الفئة الثانية:
يغير اللجند بشكل كبير البنية الثلاثية للبروتين ، وفي هذه الحالة فقط يصبح البروتين نشطًا بدرجة كافية.
مثال على ذلك هو ارتباط أيونات Ca2 * بالكالودولين ، وهو مستقبل داخل الخلايا لهذه الأيونات. من خلال ربط اثنين من أيونات Ca2 * ، يكتسب الكالمودولين القدرة على التأثير على نشاط العديد من بروتينات الخلايا.
تفاعلات الفئة الثالثة:
في حالة عدم وجود يجند ، يكون البروتين في ما يسمى. في حالة الكريات المنصهرة: لها شكل كروي مضغوط إلى حد ما ، ولكن بدون أي بنية ثلاثية محددة - يتشكل الأخير فقط عندما يكون الترابط مرتبطًا.
مثال على هذا البروتين هو lactalbumin (أحد مكونات مركب إنزيم تخليق اللاكتوز). إنه بروتين صغير يحتوي على 4 روابط ثاني كبريتيد ويرتبط بإحكام 1 Ca * أيون. على ما يبدو ، هذا الأيون هو عنصر أساسي في تكوين البنية. عندما يتم إزالته ، يتم تدمير البنية الثلاثية للبروتين. ولكن يتم الحفاظ على الشكل الكروي وحجم الكريات بسبب تأثير استقرار روابط ثاني كبريتيد.
تفاعلات الفئة الرابعة:
بدون يجند ، لا يتشكل الهيكل الثانوي للبروتين بشكل كامل ويكون الهيكل الثالث غائبًا تمامًا. في هذه الحالة ، تتكشف سلسلة الببتيد جزئيًا.
مثال على بروتين أوستيوكالسين الموجود في مصفوفة العظام. يحتوي فقط على حوالي 50 بقايا من الأحماض الأمينية ، وهو قادر على ربط 5 أيونات الكالسيوم. ويصاحب الارتباط انخفاض كبير في حجم الكريات ، وتشكيل بنية ثلاثية ، وترابط الكريات في ثنائيات. في هذه الحالة ، يعتبر الليجند ضروريًا للبروتين ليكون له أيضًا هيكل رباعي.
تفاعلات الفئة الخامسة:
في حالة عدم وجود رابط ، تكون سلسلة البروتين مكشوفة بالكامل تقريبًا ، أي أنها ملف عشوائي. يؤدي التفاعل مع الليجند إلى التكوين الكامل للبنية المكانية للبروتين.
مثال على ذلك هو السيتوكروم ج ، أحد بروتينات سلسلة نقل الإلكترون في الميتوكوندريا. ليجنده هو الهيم (على غرار الهيموغلوبين). تؤدي إزالة الموضوع إلى تكشف شبه كامل لجزيء البروتين.
تفاعلات الفئة السادسة:
يتسبب ارتباط Ligand في حدوث تحولات واسعة النطاق في مجالات البروتين أو الوحدات الفرعية.
مثال على ذلك هو تفاعل الهيموجلوبين (Hb) مع الأكسجين. تحدث العديد من التحولات التوافقية المعقدة خلال هذه العملية. بما في ذلك الوحدات الفرعية المجاورة بالتناوب بالنسبة لبعضها البعض بمقدار 10 15 ".
نتيجة لذلك ، عندما يرتبط جزيء O2 بالهيم لوحدة فرعية واحدة ، يزداد تقارب الأكسجين للوحدات الفرعية المجاورة. يشار إلى هذا باسم التأثير التعاوني وله أهمية فسيولوجية كبيرة.
في ختام هذا القسم نقدم ملاحظتين:
أ) أولاً ، كما يمكن رؤيته ، يمكن أن يكون للروابط بالفعل تأثير كبير جدًا على تكوين البروتين ؛
ب) ثانيًا ، بالنسبة للبروتين الذي يحتوي على العديد من الروابط (خاصةً إذا كان الأخير يرتبط بأجزاء مختلفة من الجزيء) ، يمكن أن تكون طبيعة مثل هذا التأثير بالنسبة للروابط المختلفة مختلفة تمامًا.
على سبيل المثال ، تؤثر روابطه ، مثل الهيم والأكسجين ، على بنية الهيموغلوبين بطرق مختلفة.
لذلك ، على عكس مؤلفي التنظيم المقدم هنا (V.N.Uversky و N.V. Narizhneva) ، لم نتحدث عن فئات البروتينات ، ولكن عن فئات تفاعلات البروتين الرابط.
هيكل الوحدة | المواضيع |
وحدة نمطية 1 | 1.1 التنظيم الهيكلي للبروتينات. مراحل تكوين التشكل الأصلي للبروتينات 1.2 أساسيات عمل البروتين. الأدوية التي تؤثر على وظيفة البروتين مثل الربيطات 1.3 تمسخ البروتين وإمكانية تجديده التلقائي |
وحدة معيارية 2 | 1.4 ملامح هيكل وعمل البروتينات قليلة القسيمات على سبيل المثال الهيموجلوبين 1.5 الحفاظ على التكوين الأصلي للبروتينات في الخلية 1.6 مجموعة متنوعة من البروتينات. عائلات البروتين على سبيل المثال من الغلوبولين المناعي 1.7 الخصائص الفيزيائية والكيميائية للبروتينات وطرق فصلها |
الوحدة المعيارية 1 التنظيم الهيكلي للبروتينات الأحادية وأساس عملها
أهداف التعلم لتكون قادرًا على:
1. استخدام المعرفة حول السمات الهيكلية للبروتينات واعتماد وظائف البروتين على بنيتها لفهم آليات تطور اعتلالات البروتين الوراثية والمكتسبة.
2. شرح آليات العمل العلاجي لبعض الأدوية مثل الروابط التي تتفاعل مع البروتينات وتغير نشاطها.
3. استخدام المعرفة حول البنية والقدرة التوافقية للبروتينات لفهم عدم الاستقرار الهيكلي والوظيفي والميل إلى تمسخ في ظل الظروف المتغيرة.
4. شرح استخدام عوامل تغيير الطبيعة كوسيلة لتعقيم المواد والأدوات الطبية ، وكذلك المطهرات.
يعرف:
1. مستويات التنظيم الهيكلي للبروتينات.
2. أهمية البنية الأساسية للبروتينات ، والتي تحدد تنوعها البنيوي والوظيفي.
3. آلية تكوين المركز النشط في البروتينات وتفاعله النوعي مع الليجند الذي يقوم عليه عمل البروتينات.
4. أمثلة على تأثير الروابط الخارجية (الأدوية ، السموم ، السموم) على التشكل والنشاط الوظيفي للبروتينات.
5. أسباب وتأثيرات تمسخ البروتين ، العوامل التي تسبب تمسخ.
6. أمثلة على استخدام عوامل تغيير الطبيعة في الطب كمطهرات ووسيلة لتعقيم الأدوات الطبية.
الموضوع 1.1. التنظيم الهيكلي للبروتينات. مراحل تكوين أصلية
تركيبات البروتين
البروتينات عبارة عن جزيئات بوليمر ، تتكون مونومرات منها من 20 حمض أميني ألفا فقط. يتم تحديد مجموعة وترتيب اتصال الأحماض الأمينية في البروتين من خلال بنية الجينات في الحمض النووي للأفراد. كل بروتين ، وفقًا لبنيته الخاصة ، يؤدي وظيفته الخاصة. تحدد مجموعة البروتينات الخاصة بكائن حي معين سماته المظهرية ، بالإضافة إلى وجود أمراض وراثية أو الاستعداد لتطورها.
1. الأحماض الأمينية التي تتكون منها البروتينات. السندات الببتيد.البروتينات عبارة عن بوليمرات مبنية من مونومرات - 20 حمض أميني ألفا ، الصيغة العامة لها هي
تختلف الأحماض الأمينية في التركيب والحجم والخصائص الفيزيائية والكيميائية للجذور المرتبطة بذرة الكربون ألفا. تحدد المجموعات الوظيفية للأحماض الأمينية خصائص خصائص الأحماض الأمينية المختلفة. يمكن تقسيم الجذور الموجودة في الأحماض الأمينية ألفا إلى عدة مجموعات:
البرولين ،خلافا لمونومرات البروتين التسعة عشر الأخرى ، ليس حمض أميني ، ولكن حمض إيميني ، فإن الراديكالي في البرولين مرتبط بكل من ذرة الكربون ألفا ومجموعة إيمينو
 تختلف الأحماض الأمينية في قابليتها للذوبان في الماء.هذا يرجع إلى قدرة الجذور على التفاعل مع الماء (لترطيبها).
تختلف الأحماض الأمينية في قابليتها للذوبان في الماء.هذا يرجع إلى قدرة الجذور على التفاعل مع الماء (لترطيبها).
إلى محبة للماءتشمل الجذور التي تحتوي على مجموعات وظيفية أنيونية وكاتيونية وقطبية غير مشحونة.
إلى نافرة من الماءتشمل الجذور التي تحتوي على مجموعات الميثيل أو السلاسل أو الدورات الأليفاتية.
2. روابط الببتيد تربط الأحماض الأمينية بالببتيدات.أثناء تخليق الببتيد ، تتفاعل مجموعة α-carboxyl لأحد الأحماض الأمينية مع مجموعة α-amino لحمض أميني آخر لتشكيل السندات الببتيد:
البروتينات هي عديد ببتيدات ، أي البوليمرات الخطية للأحماض الأمينية ألفا متصلة بواسطة رابطة الببتيد (الشكل 1.1.)
 أرز. 1.1 المصطلحات المستخدمة في وصف بنية الببتيدات
أرز. 1.1 المصطلحات المستخدمة في وصف بنية الببتيدات
تسمى مونومرات الأحماض الأمينية التي تتكون منها عديدات الببتيدات بقايا الأحماض الأمينية.سلسلة مجموعات متكررة - NH- CH- كو- نماذج العمود الفقري الببتيد.تسمى بقايا الأحماض الأمينية التي تحتوي على مجموعة α-amino الحرة N-terminal ، وتسمى البقايا التي تحتوي على مجموعة α-carboxyl الحرة C-terminal. تتم كتابة وقراءة الببتيدات من الطرف N إلى الطرف C.
تختلف رابطة الببتيد المكونة من مجموعة إيمينو من البرولين عن روابط الببتيد الأخرى: تفتقر ذرة النيتروجين في مجموعة الببتيد إلى الهيدروجين ،
بدلاً من ذلك ، هناك رابط مع الراديكالي ، ونتيجة لذلك ، يتم تضمين جانب واحد من الدورة في العمود الفقري للببتيد:
 تختلف الببتيدات في تكوين الأحماض الأمينية ، وعدد الأحماض الأمينية وترتيب الأحماض الأمينية ، على سبيل المثال ، Ser-Ala-Glu-Gis و His-Glu-Ala-Ser هما ببتيدان مختلفان.
تختلف الببتيدات في تكوين الأحماض الأمينية ، وعدد الأحماض الأمينية وترتيب الأحماض الأمينية ، على سبيل المثال ، Ser-Ala-Glu-Gis و His-Glu-Ala-Ser هما ببتيدان مختلفان.
روابط الببتيد قوية جدًا ، وهناك حاجة إلى ظروف قاسية للتحلل المائي الكيميائي غير الإنزيمي: يتم تحلل البروتين الذي تم تحليله في حمض الهيدروكلوريك المركز عند درجة حرارة حوالي 110 درجة مئوية لمدة 24 ساعة. في الخلية الحية ، يمكن كسر روابط الببتيد الإنزيمات المحللة للبروتين،اتصل البروتيازأو هيدروليسات الببتيد.
3. الهيكل الأساسي للبروتينات.لا تتناوب بقايا الأحماض الأمينية في سلاسل الببتيد لبروتينات مختلفة بشكل عشوائي ، بل يتم ترتيبها بترتيب معين. يسمى التسلسل الخطي أو تسلسل بقايا الأحماض الأمينية في سلسلة عديد الببتيد التركيب الأساسي للبروتين.
يتم ترميز التركيب الأساسي لكل بروتين فردي في جزيء DNA (في منطقة تسمى الجين) ويتم تحقيقه أثناء النسخ (إعادة كتابة المعلومات على mRNA) والترجمة (تخليق البنية الأساسية للبروتين). وبالتالي ، فإن التركيب الأساسي لبروتينات الفرد هو المعلومات الموروثة من الآباء إلى الأطفال التي تحدد السمات الهيكلية لبروتينات كائن حي معين ، والتي تعتمد عليها وظيفة البروتينات الموجودة (الشكل 1.2).
 أرز. 1.2 العلاقة بين النمط الجيني وتشكل البروتينات المركبة في جسم الفرد
أرز. 1.2 العلاقة بين النمط الجيني وتشكل البروتينات المركبة في جسم الفرد
يحتوي كل بروتين من حوالي 100000 بروتين في جسم الإنسان فريدة من نوعهاالهيكل الأساسي. جزيئات نوع واحد من البروتين (على سبيل المثال ، الألبومين) لها نفس التناوب لبقايا الأحماض الأمينية ، والتي تميز الألبومين عن أي بروتين فردي آخر.
يمكن اعتبار تسلسل بقايا الأحماض الأمينية في سلسلة الببتيد شكلاً من أشكال تسجيل المعلومات. تحدد هذه المعلومات الطي المكاني لسلسلة الببتيد الخطي إلى هيكل ثلاثي الأبعاد أكثر إحكاما يسمى التشكلسنجاب. تسمى عملية تكوين تكوين البروتين النشط وظيفيًا قابلة للطي.
4. تكوين البروتينات.يكون الدوران الحر في العمود الفقري للببتيد ممكنًا بين ذرة النيتروجين في مجموعة الببتيد وذرة الكربون ألفا المجاورة ، وكذلك بين ذرة الكربون ألفا وكربون مجموعة الكربونيل. بسبب تفاعل المجموعات الوظيفية لبقايا الأحماض الأمينية ، يمكن أن يكتسب الهيكل الأساسي للبروتينات هياكل مكانية أكثر تعقيدًا. في البروتينات الكروية ، يتم تمييز مستويين رئيسيين من طي تشكيل سلاسل الببتيد: ثانويو الهيكل الثالث.
التركيب الثانوي للبروتينات- هذه بنية مكانية تشكلت نتيجة تكوين روابط هيدروجينية بين المجموعات الوظيفية -C = O و -NH- من العمود الفقري للببتيد. في هذه الحالة ، يمكن أن تكتسب سلسلة الببتيد هياكل منتظمة من نوعين: α- حلزوناتو β الهياكل.
في α- حلزوناتتتشكل روابط الهيدروجين بين ذرة الأكسجين لمجموعة الكاربونيل وهيدروجين نيتروجين الأميد للحمض الأميني الرابع منه ؛ سلاسل جانبية لبقايا الأحماض الأمينية
تقع على طول محيط اللولب ، ولا تشارك في تشكيل الهيكل الثانوي (الشكل 1.3.).
تمنع الجذور أو الجذور الضخمة التي تحمل نفس الشحنات تكون α-helix. بقايا البرولين ، التي لها هيكل حلقي ، تقاطع الحلزون α ، لأنه بسبب نقص الهيدروجين في ذرة النيتروجين في سلسلة الببتيد ، من المستحيل تكوين رابطة هيدروجينية. الرابطة بين النيتروجين وذرة الكربون ألفا هي جزء من دورة البرولين ، لذلك يكتسب العمود الفقري للببتيد منحنى في هذا المكان.
β- الهيكلبين المناطق الخطية للعمود الفقري الببتيد لسلسلة بولي ببتيد واحدة ، وبالتالي تشكيل هياكل مطوية. يمكن أن تتشكل سلاسل البولي ببتيد أو أجزاء منها موازىأو الهياكل β المضادة.في الحالة الأولى ، تتطابق المحطات الطرفية N و C لسلاسل الببتيد المتفاعل ، وفي الحالة الثانية ، يكون لها الاتجاه المعاكس (الشكل 1.4).
أرز. 1.3 الهيكل الثانوي للبروتين - α-helix
 أرز. 1.4 هياكل مطوية متوازية ومضادة للتوازي
أرز. 1.4 هياكل مطوية متوازية ومضادة للتوازي
يُشار إلى الهياكل β بأسهم عريضة: أ - هيكل غير متوازي. ب - الهياكل المتوازية المطوية β
في بعض البروتينات ، يمكن تشكيل هياكل β بسبب تكوين روابط هيدروجينية بين ذرات العمود الفقري للببتيد في سلاسل متعددة الببتيد المختلفة.
توجد أيضًا في البروتينات المناطق ذات الثانوية غير المنتظمةالهيكل ، والذي يشمل الانحناءات ، الحلقات ، المنعطفات من العمود الفقري متعدد الببتيد. غالبًا ما توجد في الأماكن التي يتغير فيها اتجاه سلسلة الببتيد ، على سبيل المثال ، أثناء تكوين بنية متوازية من الصفائح.
من خلال وجود حلزونات α وهياكل ، يمكن تقسيم البروتينات الكروية إلى أربع فئات.
أرز. 1.5 الهيكل الثانوي للميوغلوبين (أ) وسلسلة الهيموغلوبين (ب) ، التي تحتوي على ثمانية حلزونات ألفا

 أرز. 1.6 الهيكل الثانوي لأيزوميراز ثلاثي الفوسفات ومجال بيروفات كيناز
أرز. 1.6 الهيكل الثانوي لأيزوميراز ثلاثي الفوسفات ومجال بيروفات كيناز
 أرز. 1.7 الهيكل الثانوي للمجال الثابت للجلوبيولين المناعي (A) وإنزيم ديسموتاز الفائق (B)
أرز. 1.7 الهيكل الثانوي للمجال الثابت للجلوبيولين المناعي (A) وإنزيم ديسموتاز الفائق (B)
في الفئة الرابعةتضمنت بروتينات تحتوي في تكوينها على كمية صغيرة من الهياكل الثانوية المنتظمة. تشمل هذه البروتينات بروتينات صغيرة غنية بالسيستين أو بروتينات معدنية.
البنية الثلاثية للبروتين- نوع من التشكل يتكون بسبب التفاعلات بين جذور الأحماض الأمينية ، والتي يمكن أن توجد على مسافة كبيرة من بعضها البعض في سلسلة الببتيد. في هذه الحالة ، تشكل معظم البروتينات بنية مكانية تشبه الكريات (بروتينات كروية).
نظرًا لأن الجذور الكارهة للماء للأحماض الأمينية تميل إلى الاندماج بمساعدة ما يسمى التفاعلات الطاردة للماءوقوى فان دير فال بين الجزيئية ، يتم تكوين قلب كثيف كاره للماء داخل كريات البروتين. توجد الجذور المؤينة وغير المؤينة للماء بشكل أساسي على سطح البروتين وتحدد قابليته للذوبان في الماء.
 أرز. 1.8 أنواع الروابط التي تنشأ بين جذور الأحماض الأمينية أثناء تكوين البنية الثلاثية للبروتين
أرز. 1.8 أنواع الروابط التي تنشأ بين جذور الأحماض الأمينية أثناء تكوين البنية الثلاثية للبروتين
1 - الرابطة الأيونية- يحدث بين المجموعات الوظيفية الموجبة والسالبة الشحنة ؛
2 - رابطة الهيدروجين- يحدث بين الماء غير المشحون وأي مجموعة محبة للماء ؛
3 - التفاعلات الطاردة للماء- تحدث بين الجذور الكارهة للماء ؛
4 - السندات ثاني كبريتيد- يتشكل بسبب أكسدة مجموعات SH من بقايا السيستين وتفاعلها مع بعضها البعض
يمكن أن تتفاعل بقايا الأحماض الأمينية المحبة للماء داخل قلب مسعور مع بعضها البعض باستخدام أيونيو روابط هيدروجينية(الشكل 1.8).
الروابط الأيونية والهيدروجينية ، بالإضافة إلى التفاعلات الكارهة للماء ، من بين التفاعلات الضعيفة: طاقتها تفوق قليلاً طاقة الحركة الحرارية للجزيئات في درجة حرارة الغرفة. يتم الحفاظ على تكوين البروتين من خلال حدوث العديد من هذه الروابط الضعيفة. نظرًا لأن الذرات التي يتكون منها البروتين تتحرك باستمرار ، فمن الممكن كسر بعض الروابط الضعيفة وتشكيل روابط أخرى ، مما يؤدي إلى حركات صغيرة لأقسام فردية من سلسلة البولي ببتيد. تسمى هذه الخاصية من البروتينات لتغيير الشكل نتيجة كسر بعضها وتشكيل روابط ضعيفة أخرى التوافقية.
جسم الإنسان لديه أنظمة تدعم التوازن- ثبات البيئة الداخلية ضمن حدود معينة مقبولة لكائن حي سليم. في ظل ظروف الاستتباب ، لا تؤدي التغييرات الصغيرة في التشكل إلى تعطيل البنية الكلية ووظيفة البروتينات. يسمى التكوين النشط وظيفيًا للبروتين التشكل الأصلي.يؤدي التغيير في البيئة الداخلية (على سبيل المثال ، تركيز الجلوكوز وأيونات الكالسيوم والبروتونات وما إلى ذلك) إلى تغيير في تكوين وظائف البروتينات وتعطيلها.
استقرت البنية الثلاثية لبعض البروتينات روابط ثاني كبريتيد،يتكون من تفاعل مجموعات -SH من اثنين من البقايا
 أرز. 1.9 تكوين رابطة ثاني كبريتيد في جزيء بروتين
أرز. 1.9 تكوين رابطة ثاني كبريتيد في جزيء بروتين
السيستين (الشكل 1.9). لا تحتوي معظم البروتينات داخل الخلايا على روابط ثاني كبريتيد تساهمية في هيكلها الثالث. إن وجودها هو سمة من سمات البروتينات التي تفرزها الخلية ، مما يضمن ثباتًا أكبر في الظروف خارج الخلية. لذلك ، توجد روابط ثاني كبريتيد في جزيئات الأنسولين والغلوبولين المناعي.
الأنسولين- هرمون بروتيني يتم تصنيعه في خلايا في البنكرياس ويتم إفرازه في الدم استجابة لزيادة تركيز الجلوكوز في الدم. في بنية الأنسولين ، يوجد رابطان ثنائي كبريتيد يربطان السلاسل المتعددة الببتيد A و B ، ورابطة ثاني كبريتيد واحدة داخل السلسلة A (الشكل 1.10).
 أرز. 1.10. روابط ثاني كبريتيد في بنية الأنسولين
أرز. 1.10. روابط ثاني كبريتيد في بنية الأنسولين
5. بنية ثانوية فائقة للبروتينات.في بروتينات مختلفة في البنية الأساسية والوظائف ، في بعض الأحيان مجموعات مماثلة وتوسط الهياكل الثانوية ،والتي تسمى البنية الفائقة الثانوية. إنه يحتل موقعًا وسيطًا بين الهياكل الثانوية والثالثية ، لأنه مزيج محدد من عناصر البنية الثانوية أثناء تكوين البنية الثلاثية للبروتين. الهياكل الثانوية الفائقة لها أسماء محددة مثل "α-helix-turn-a-helix" ، "leucine zipper" ، "zinc finger finger" ، إلخ. هذه الهياكل الفائقة الثانوية هي سمة من سمات بروتينات ربط الحمض النووي.
"لوسين سستة".يستخدم هذا النوع من البنية الثانوية الفائقة لربط بروتينين. توجد على سطح البروتينات المتفاعلة مناطق حلزونية ألفا تحتوي على أربعة بقايا ليوسين على الأقل. توجد بقايا Leucine في α-helix ستة أحماض أمينية منفصلة عن بعضها البعض. نظرًا لأن كل منعطف من α-helix يحتوي على 3.6 من بقايا الأحماض الأمينية ، تم العثور على جذور الليوسين على سطح كل دورة ثانية. يمكن لبقايا الليوسين الموجودة في حلزون α لبروتين واحد أن تتفاعل مع بقايا الليوسين لبروتين آخر (تفاعلات كارهة للماء) ، وتربطها معًا (الشكل 1.11). تعمل العديد من البروتينات المرتبطة بالحمض النووي كجزء من معقدات قليلة القسيمات ، حيث ترتبط الوحدات الفرعية الفردية ببعضها البعض بواسطة "سحابات الليوسين".
 أرز. 1.11. "Leucine zipper" بين المناطق الحلزونية α لبروتينين
أرز. 1.11. "Leucine zipper" بين المناطق الحلزونية α لبروتينين
الهستونات هي مثال على هذه البروتينات. الهستونات- البروتينات النووية والتي تحتوي على عدد كبير من الأحماض الأمينية موجبة الشحنة - أرجينين ولايسين (تصل إلى 80٪). يتم دمج جزيئات هيستون في مجمعات قليلة القسيمات تحتوي على ثمانية مونومرات بمساعدة "مثبتات الليوسين" ، على الرغم من الشحنة المتجانسة الكبيرة لهذه الجزيئات.
"إصبع الزنك"- شكل متغير من التركيب الفائق الثانوي ، المميز لبروتينات ربط الحمض النووي ، شكل جزء ممدود على سطح البروتين ويحتوي على حوالي 20 بقايا من الأحماض الأمينية (الشكل 1.12). يتم دعم شكل "الإصبع المشدود" بواسطة ذرة الزنك المرتبطة بأربعة جذور من الأحماض الأمينية - اثنان من بقايا السيستين واثنين من بقايا الهيستدين. في بعض الحالات ، بدلاً من بقايا الهيستيدين ، توجد بقايا السيستين. يتم فصل بقايا السيستين المتباعدة عن كثب عن بقايا Gisili الأخرى بواسطة تسلسل Cys لما يقرب من 12 من بقايا الأحماض الأمينية. تشكل هذه المنطقة من البروتين α-helix ، يمكن أن ترتبط جذوره على وجه التحديد بالمناطق التنظيمية للأخدود الرئيسي للحمض النووي. خصوصية ارتباط الفرد
 أرز. 1.12. الهيكل الأساسي لقسم من البروتينات المرتبطة بالحمض النووي التي تشكل بنية "إصبع الزنك" (تشير الأحرف إلى الأحماض الأمينية التي تشكل هذا الهيكل)
أرز. 1.12. الهيكل الأساسي لقسم من البروتينات المرتبطة بالحمض النووي التي تشكل بنية "إصبع الزنك" (تشير الأحرف إلى الأحماض الأمينية التي تشكل هذا الهيكل)
يعتمد بروتين ربط الحمض النووي التنظيمي على تسلسل بقايا الأحماض الأمينية الموجودة في "إصبع الزنك". تحتوي هذه الهياكل ، على وجه الخصوص ، على مستقبلات لهرمونات الستيرويد المشاركة في تنظيم النسخ (قراءة المعلومات من الحمض النووي إلى الحمض النووي الريبي).
الموضوع 1.2. أسس عمل البروتين. الأدوية التي تؤثر على وظيفة البروتين
1. المركز النشط للبروتين وتفاعله مع الليجند.أثناء تكوين البنية الثلاثية ، على سطح البروتين النشط وظيفيًا ، عادةً في فترة راحة ، يتشكل الموقع بواسطة جذور الأحماض الأمينية التي تكون متباعدة في الهيكل الأساسي. هذا الموقع ، الذي يحتوي على بنية فريدة لبروتين معين وقادر على التفاعل بشكل خاص مع جزيء معين أو مجموعة من الجزيئات المماثلة ، يسمى موقع ارتباط البروتين مع رابط أو موقع نشط. الروابط هي جزيئات تتفاعل مع البروتينات.
خصوصية عاليةيتم ضمان تفاعل البروتين مع الليجند من خلال تكامل بنية المركز النشط مع بنية الترابط.
التكاملهي المراسلات المكانية والكيميائية للأسطح المتفاعلة. يجب ألا يتوافق المركز النشط مكانيًا فقط مع الترابط المتضمن فيه ، ولكن أيضًا بين المجموعات الوظيفية للجذور المتضمنة في المركز النشط والرابط ، يجب تكوين روابط (تفاعلات أيونية وهيدروجينية وكارهة للماء) تحافظ على الترابط. في المركز النشط (الشكل 1.13).
 أرز. 1.13. التفاعل التكميلي لبروتين مع يجند
أرز. 1.13. التفاعل التكميلي لبروتين مع يجند
تلعب بعض الروابط ، عند ربطها بالمركز النشط للبروتين ، دورًا مساعدًا في عمل البروتينات. تسمى هذه الروابط بالعوامل المساعدة ، وتسمى البروتينات التي تحتوي على جزء غير بروتيني في تركيبتها بروتينات معقدة(على عكس البروتينات البسيطة التي تتكون فقط من جزء البروتين). يسمى الجزء غير البروتيني المرتبط بشدة بالبروتين مجموعه اطراف صناعيه.على سبيل المثال ، تحتوي تركيبة الميوغلوبين والهيموغلوبين والسيتوكروم على مجموعة صناعية مرتبطة بقوة بالمركز النشط - هيم يحتوي على أيون حديد. تسمى البروتينات المعقدة التي تحتوي على الهيم بروتينات الدم.
عندما يتم ربط روابط محددة بالبروتينات ، تتجلى وظيفة هذه البروتينات. وهكذا ، يُظهر الألبومين ، وهو أهم بروتين في بلازما الدم ، وظيفة النقل الخاصة به عن طريق ربط روابط كارهة للماء بالمركز النشط ، مثل الأحماض الدهنية ، والبيليروبين ، وبعض الأدوية ، وما إلى ذلك (الشكل 1.14)
تتفاعل الروابط التي تتفاعل مع الهيكل ثلاثي الأبعاد لسلسلة الببتيد ليس فقط جزيئات عضوية وغير عضوية منخفضة الوزن الجزيئي ، ولكن أيضًا الجزيئات الكبيرة:
الحمض النووي (نوقشت الأمثلة أعلاه مع بروتينات ربط الحمض النووي) ؛
السكريات.
 أرز. 1.14 العلاقة بين النمط الجيني والنمط الظاهري
أرز. 1.14 العلاقة بين النمط الجيني والنمط الظاهري
يتم تحقيق التركيب الأساسي الفريد للبروتينات البشرية ، المشفرة في جزيء الحمض النووي ، في الخلايا في شكل تشكيل فريد ، وبنية موقع نشط ، ووظائف بروتينية.
في هذه الحالات ، يتعرف البروتين على منطقة معينة من الليجند تتناسب مع موقع الارتباط ومكملة له. لذلك يوجد على سطح خلايا الكبد بروتينات مستقبلية لهرمون الأنسولين ، والذي يحتوي أيضًا على بنية بروتينية. يؤدي تفاعل الأنسولين مع المستقبلات إلى تغيير في شكله وتفعيل أنظمة الإشارات ، مما يؤدي إلى تراكم العناصر الغذائية في خلايا الكبد بعد تناول الطعام.
في هذا الطريق، يعتمد عمل البروتينات على التفاعل المحدد للمركز النشط للبروتين مع اللجند.
2. بنية المجال ودورها في عمل البروتينات.غالبًا ما تنثني سلاسل البولي ببتيد الطويلة من البروتينات الكروية إلى عدة مناطق مدمجة ومستقلة نسبيًا. لديهم بنية ثلاثية مستقلة ، تشبه تلك الموجودة في البروتينات الكروية ، وتسمى المجالات.بسبب بنية المجال للبروتينات ، يسهل تكوين هيكلها الثالث.
في بروتينات المجال ، غالبًا ما توجد مواقع ربط الترابط بين المجالات. لذلك ، فإن التربسين هو إنزيم محلل للبروتين ينتج عن طريق الجزء الخارجي من البنكرياس وهو ضروري لهضم البروتينات الغذائية. له هيكل ثنائي المجال ، ويقع موقع ربط التربسين مع ليجنده - بروتين الطعام - في الأخدود بين المجالين. في المركز النشط ، يتم إنشاء الشروط اللازمة للربط الفعال لموقع معين من البروتين الغذائي والتحلل المائي للروابط الببتيدية.
يمكن أن تتحرك المجالات المختلفة في البروتين بالنسبة لبعضها البعض عندما يتفاعل المركز النشط مع الترابط (الشكل 1.15).
هيكسوكيناز- إنزيم يحفز فسفرة الجلوكوز بمساعدة ATP. يقع الموقع النشط للإنزيم في الشق بين المجالين. عندما يرتبط hexokinase بالجلوكوز ، تغلق المجالات المحيطة وتحتجز الطبقة السفلية ، حيث تحدث الفسفرة (انظر الشكل 1.15).
 أرز. 1.15. ربط مجالات هيكسوكيناز بالجلوكوز
أرز. 1.15. ربط مجالات هيكسوكيناز بالجلوكوز
في بعض البروتينات ، تؤدي المجالات وظائف مستقلة عن طريق الارتباط بروابط مختلفة. تسمى هذه البروتينات متعددة الوظائف.
3. الأدوية - الروابط التي تؤثر على وظيفة البروتينات.تفاعل البروتينات مع الروابط محدد. ومع ذلك ، نظرًا للقدرة التوافقية للبروتين وموقعه النشط ، فمن الممكن اختيار مادة أخرى يمكن أن تتفاعل أيضًا مع البروتين في الموقع النشط أو جزء آخر من الجزيء.
تسمى المادة التي تشبه في تركيبها الترابط الطبيعي التناظرية الهيكلية للليغندأو يجند غير طبيعي. يتفاعل أيضًا مع بروتين في الموقع النشط. يمكن للتماثل الهيكلي للرابط أن يعزز وظيفة البروتين (ناهض)وتقليله (خصم).يتنافس اللجند ونظائره الهيكلية مع بعضها البعض لربط البروتين في نفس الموقع. تسمى هذه المواد المغيرات التنافسية(منظمات) وظائف البروتين. تعمل العديد من الأدوية كمثبطات للبروتين. يتم الحصول على بعضها عن طريق التعديل الكيميائي للروابط الطبيعية. يمكن أن تكون مثبطات وظيفة البروتين أدوية وسموم.
الأتروبين هو مثبط تنافسي للمستقبلات الكولينية M.الأسيتيل كولين هو ناقل عصبي لنقل النبضات العصبية من خلال المشابك الكولينية. لإجراء الإثارة ، يجب أن يتفاعل الأسيتيل كولين المنطلق في الشق المشبكي مع البروتين - مستقبل الغشاء ما بعد المشبكي. تم العثور على نوعين المستقبلات الكولينية:
مستقبلات Mبالإضافة إلى أستيل كولين ، فإنه يتفاعل بشكل انتقائي مع المسكارين (ذيفان غاريق الذبابة). توجد المستقبلات الكولينية M على العضلات الملساء وتسبب تقلصها عند التفاعل مع الأسيتيل كولين ؛
مستقبلات Hيرتبط بالنيكوتين على وجه التحديد. تم العثور على مستقبلات N-الكوليني في نقاط الاشتباك العصبي من عضلات الهيكل العظمي المخططة.
مثبط محدد مستقبلات م الكولينيةهو الأتروبين. تم العثور عليها في نباتات البلادونا والهيبان.
 يحتوي الأتروبين على مجموعات وظيفية وترتيبها المكاني مشابه للأسيتيل كولين في هيكله ، وبالتالي فهو ينتمي إلى مثبطات تنافسية لمستقبلات M-الكولينية. بالنظر إلى أن ارتباط الأسيتيل كولين بمستقبلات M-الكولينية يتسبب في تقلص العضلات الملساء ، يتم استخدام الأتروبين كدواء يخفف من تشنجها. (مضاد للتشنج).وبالتالي ، من المعروف استخدام الأتروبين لإرخاء عضلات العين عند رؤية قاع العين ، وكذلك لتخفيف التشنجات في المغص المعدي المعوي. توجد مستقبلات M-الكولينية أيضًا في الجهاز العصبي المركزي (CNS) ، لذا فإن الجرعات الكبيرة من الأتروبين يمكن أن تسبب تفاعلًا غير مرغوب فيه من الجهاز العصبي المركزي: التحريض الحركي والعقلي ، والهلوسة ، والتشنجات.
يحتوي الأتروبين على مجموعات وظيفية وترتيبها المكاني مشابه للأسيتيل كولين في هيكله ، وبالتالي فهو ينتمي إلى مثبطات تنافسية لمستقبلات M-الكولينية. بالنظر إلى أن ارتباط الأسيتيل كولين بمستقبلات M-الكولينية يتسبب في تقلص العضلات الملساء ، يتم استخدام الأتروبين كدواء يخفف من تشنجها. (مضاد للتشنج).وبالتالي ، من المعروف استخدام الأتروبين لإرخاء عضلات العين عند رؤية قاع العين ، وكذلك لتخفيف التشنجات في المغص المعدي المعوي. توجد مستقبلات M-الكولينية أيضًا في الجهاز العصبي المركزي (CNS) ، لذا فإن الجرعات الكبيرة من الأتروبين يمكن أن تسبب تفاعلًا غير مرغوب فيه من الجهاز العصبي المركزي: التحريض الحركي والعقلي ، والهلوسة ، والتشنجات.
Ditilin هو ناهض تنافسي لمستقبلات H-cholinergic الذي يثبط وظيفة المشابك العصبية العضلية.
 تحتوي المشابك العصبية العضلية للعضلات الهيكلية على مستقبلات H-الكولينية. تفاعلهم مع أستيل كولين يؤدي إلى تقلصات العضلات. في بعض العمليات الجراحية وكذلك في الدراسات التنظيرية ، يتم استخدام الأدوية التي تسبب ارتخاء عضلات الهيكل العظمي. (مرخيات العضلات).وتشمل هذه الديثيلين ، وهو نظير هيكلي للأسيتيل كولين. يرتبط بمستقبلات H-cholinergic ، ولكن على عكس الأسيتيل كولين ، يتم تدميره ببطء شديد بواسطة إنزيم أستيل كولينستراز. نتيجة للفتح المطول للقنوات الأيونية واستمرار إزالة الاستقطاب للغشاء ، يتم تعطيل توصيل النبضات العصبية ويحدث ارتخاء العضلات. في البداية ، تم العثور على هذه الخصائص في سم الكار ، لذلك تسمى هذه الأدوية curariform.
تحتوي المشابك العصبية العضلية للعضلات الهيكلية على مستقبلات H-الكولينية. تفاعلهم مع أستيل كولين يؤدي إلى تقلصات العضلات. في بعض العمليات الجراحية وكذلك في الدراسات التنظيرية ، يتم استخدام الأدوية التي تسبب ارتخاء عضلات الهيكل العظمي. (مرخيات العضلات).وتشمل هذه الديثيلين ، وهو نظير هيكلي للأسيتيل كولين. يرتبط بمستقبلات H-cholinergic ، ولكن على عكس الأسيتيل كولين ، يتم تدميره ببطء شديد بواسطة إنزيم أستيل كولينستراز. نتيجة للفتح المطول للقنوات الأيونية واستمرار إزالة الاستقطاب للغشاء ، يتم تعطيل توصيل النبضات العصبية ويحدث ارتخاء العضلات. في البداية ، تم العثور على هذه الخصائص في سم الكار ، لذلك تسمى هذه الأدوية curariform.
الموضوع 1.3. انتشار البروتين وإمكانية تجددها المفاجئ
1. نظرًا لأنه يتم الحفاظ على التكوين الأصلي للبروتينات بسبب التفاعلات الضعيفة ، والتغيرات في تكوين وخصائص البيئة المحيطة بالبروتين ، فإن تأثير الكواشف الكيميائية والعوامل الفيزيائية تسبب تغييرًا في شكلها (خاصية التوافق التوافقي). يؤدي تمزق عدد كبير من الروابط إلى تدمير التشكل الأصلي وتمسخ البروتين.
تمسخ البروتين- هذا هو تدمير شكلها الأصلي تحت تأثير عوامل تغيير الطبيعة ، الناجم عن كسر الروابط الضعيفة التي تثبت التركيب المكاني للبروتين. يصاحب التمسخ بتدمير الهيكل الفريد ثلاثي الأبعاد والمركز النشط للبروتين وفقدان نشاطه البيولوجي (الشكل 1.16).
تكتسب جميع الجزيئات المشوهة من بروتين واحد تشكيلًا عشوائيًا يختلف عن الجزيئات الأخرى من نفس البروتين. تحولت جذور الأحماض الأمينية التي تشكل المركز النشط إلى أن تكون بعيدة مكانيًا عن بعضها البعض ، أي يتم تدمير موقع الارتباط المحدد للبروتين مع الليجند. أثناء التمسخ ، يبقى الهيكل الأساسي للبروتينات دون تغيير.
استخدام عوامل تغيير الطبيعة في البحوث البيولوجية والطب.في الدراسات البيوكيميائية ، قبل تحديد المركبات ذات الوزن الجزيئي المنخفض في مادة بيولوجية ، عادة ما تتم إزالة البروتينات من المحلول أولاً. لهذا الغرض ، غالبًا ما يستخدم حمض ثلاثي كلورو الخليك (TCA). بعد إضافة TCA إلى المحلول ، تترسب البروتينات المشوهة وتتم إزالتها بسهولة عن طريق الترشيح (الجدول 1.1.)
في الطب ، غالبًا ما تستخدم عوامل تغيير الطبيعة لتعقيم الأدوات والمواد الطبية في الأوتوكلاف (عامل تغيير طبيعة - درجة حرارة عالية) وكمطهرات (كحول ، فينول ، كلورامين) لمعالجة الأسطح الملوثة التي تحتوي على البكتيريا المسببة للأمراض.
2. تجديد البروتين العفوي- دليل على حتمية التركيب الأساسي للبروتينات وتشكيلها ووظيفتها. البروتينات الفردية هي نتاج جين واحد له تسلسل أحماض أمينية متطابق ويكتسب نفس التشكل في الخلية. الاستنتاج الأساسي القائل بأن الهيكل الأساسي للبروتين يحتوي بالفعل على معلومات حول تشكيله ووظيفته تم إجراؤه على أساس قدرة بعض البروتينات (على وجه الخصوص ، الريبونوكلياز والميوغلوبين) على التجديد التلقائي - استعادة شكلها الأصلي بعد التمسخ.
يتم تكوين الهياكل المكانية للبروتين من خلال طريقة التجميع الذاتي - وهي عملية عفوية تميل فيها سلسلة البولي ببتيد ، التي لها بنية أولية فريدة ، إلى اعتماد تشابه بأقل طاقة حرة في المحلول. تم وصف القدرة على تجديد البروتينات التي تحتفظ ببنيتها الأولية بعد تمسخها في تجربة مع إنزيم الريبونوكلياز.
الريبونوكلياز هو إنزيم يكسر الروابط بين النيوكليوتيدات الفردية في جزيء الحمض النووي الريبي. يحتوي هذا البروتين الكروي على سلسلة بولي ببتيد واحدة ، يتم تثبيت هيكلها الثلاثي بواسطة العديد من الروابط الضعيفة وأربعة روابط ثنائي كبريتيد.
علاج ريبونوكلياز مع اليوريا ، الذي يكسر روابط الهيدروجين في الجزيء ، والعامل المختزل ، الذي يكسر روابط ثاني كبريتيد ، يؤدي إلى تمسخ الإنزيم وفقدان نشاطه.
تؤدي إزالة عوامل تغيير الطبيعة عن طريق غسيل الكلى إلى استعادة تكوين البروتين ووظيفته ، أي للإنعاش. (الشكل 1.17).
 أرز. 1.17 تمسخ وإعادة تنشيط الريبونوكلياز
أرز. 1.17 تمسخ وإعادة تنشيط الريبونوكلياز
أ - التشكل الأصلي للريبونوكلياز ، في البنية الثلاثية التي توجد بها أربعة روابط ثاني كبريتيد ؛ ب - جزيء الريبونوكلياز المشوه ؛
ب - جزيء الريبونوكلياز الكلوي ذو البنية والوظيفة المستعادة
1. الجدول الكامل 1.2.
الجدول 1.2. تصنيف الأحماض الأمينية حسب قطبية الجذور
2. اكتب صيغة رباعي الببتيد:
آسيا والمحيط الهادئ - برو - فين - ليز
أ) عزل المجموعات المتكررة في الببتيد التي تشكل العمود الفقري للببتيد والمجموعات المتغيرة التي تمثلها جذور الأحماض الأمينية ؛
ب) تعيين الطرف N و C ؛
ج) وضع خط تحت روابط الببتيد.
د) كتابة ببتيد آخر يتكون من نفس الأحماض الأمينية.
ه) حساب عدد المتغيرات التي يمكن أن تتداخل مع رباعي الببتيد مع تركيبة الأحماض الأمينية مماثلة.
3. اشرح دور التركيب الأساسي للبروتينات في مثال التحليل المقارن لهرموني ببتيد متشابهين هيكليًا وقريبًا تطوريًا من الغدة النخامية العصبية للثدييات - الأوكسيتوسين والفازوبريسين (الجدول 1.3).
الجدول 1.3. هيكل ووظيفة الأوكسيتوسين والفازوبريسين
 لهذا:
لهذا:
أ) مقارنة التركيب وتسلسل الأحماض الأمينية للببتيدات ؛
ب) إيجاد تشابه البنية الأولية للببتيدتين وتشابه عملهما البيولوجي ؛
ج) إيجاد الاختلافات في بنية الببتيدات والاختلاف في وظائفهما ؛
د) استخلاص استنتاج حول تأثير البنية الأولية للببتيدات على وظائفها.
4. وصف المراحل الرئيسية في تكوين تكوين البروتينات الكروية (الهياكل الثانوية والثالثية ومفهوم البنية الفائقة الثانوية). حدد أنواع الروابط المشاركة في تكوين الهياكل البروتينية. ما هي جذور الأحماض الأمينية التي يمكن أن تشارك في تكوين التفاعلات الكارهة للماء ، والروابط الأيونية والهيدروجينية.
أعط أمثلة.
5. تحديد مفهوم "القابلية التوافقية للبروتينات" ، وبيان أسباب وجودها وأهميتها.
6. اشرح معنى العبارة التالية: "تعمل البروتينات بناءً على تفاعلها المحدد مع يجند" ، باستخدام المصطلحات وشرح معناها: تكوين البروتين ، الموقع النشط ، الرابط ، التكامل ، وظيفة البروتين.
7. باستخدام أحد الأمثلة ، اشرح ما هي المجالات وما هو دورها في عمل البروتينات.
مهام التحكم الذاتي
1. اضبط المباراة.
المجموعة الوظيفية في جذور الأحماض الأمينية:
مجموعة الكربوكسيل B. مجموعة الهيدروكسيل C مجموعة Guanidine D. مجموعة Thiol E. مجموعة Amino
2. اختر الإجابات الصحيحة.
الأحماض الأمينية ذات الجذور القطبية غير المشحونة هي:
A. Tsis B. Asn
B. Glu G. ثلاثة
3. اختر الإجابات الصحيحة.
جذور الأحماض الأمينية:
أ. توفير خصوصية الهيكل الأساسي ب. المشاركة في تشكيل الهيكل الثالث
ب. كونها موجودة على سطح البروتين ، فإنها تؤثر على قابليته للذوبان د. تشكل مركزًا نشطًا
D. المشاركة في تكوين روابط الببتيد
4. اختر الإجابات الصحيحة.
يمكن أن تتكون التفاعلات الكارهة للماء بين جذور الأحماض الأمينية:
أ. تري لاي ب. برو ثري
التقى إل جي تير ألا دي فال فين
5. اختر الإجابات الصحيحة.
يمكن أن تتكون الروابط الأيونية بين جذور الأحماض الأمينية:
أ. جلين أسب ب. أبريل ليز
ب. ليز غلو ج. أوز أسب د. آسن أبريل
6. اختر الإجابات الصحيحة.
يمكن أن تتكون روابط الهيدروجين بين جذور الأحماض الأمينية:
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. اضبط المباراة.
نوع الرابطة المشاركة في تكوين بنية البروتين:
أ. الهيكل الأساسي ب. الهيكل الثانوي
باء الهيكل الثالث
D. البنية فوق الثانوية E. التشكل.
1. الروابط الهيدروجينية بين ذرات العمود الفقري الببتيد
2. ضعف الروابط بين المجموعات الوظيفية لجذور الأحماض الأمينية
3. الروابط بين مجموعات α-amino و α-carboxyl من الأحماض الأمينية
8. اختر الإجابات الصحيحة. التربسين:
A. الإنزيم المحلل للبروتين B. يحتوي على مجالين
B. تحلل النشا
D. يقع المركز النشط بين المجالات. D. يتكون من سلسلتين عديد الببتيد.
9. اختر الإجابات الصحيحة. الأتروبين:
A. ناقل عصبي
ب. التناظرية الهيكلية للأستيل كولين
B. يتفاعل مع مستقبلات H- الكوليني
يعزز توصيل النبضات العصبية من خلال المشابك الكولينية
د- مثبط تنافسي لمستقبلات الكوليني M
10. اختر البيانات الصحيحة. في البروتينات:
A. يحتوي الهيكل الأساسي على معلومات حول بنية موقعه النشط
ب- يتكون المركز النشط على مستوى الهيكل الأساسي
يتم تثبيت التشكل بشكل صارم عن طريق الروابط التساهمية
يمكن أن يتفاعل الموقع النشط مع مجموعة من الروابط المتشابهة
بسبب قابلية التوافق للبروتينات D. تغيير البيئة يمكن أن يؤثر على تقارب النشط
مركز يجند
1. 1-ج ، 2-د ، 3-ب.
3. أ ، ب ، ج ، د.
7. 1-B ، 2-D ، 3-A.
8. أ ، ب ، ج ، د.
الشروط والمفاهيم الأساسية
1. بروتين ، عديد ببتيد ، أحماض أمينية
2. الهياكل البروتينية الأولية والثانوية والثالثية
3. التشكل ، تكوين البروتين الأصلي
4. الروابط التساهمية والضعيفة في البروتين
5. التوافقية lability
6. موقع البروتين النشط
7. يجاندس
8. طي البروتين
9. نظائرها الهيكلية من الروابط
10. بروتينات المجال
11. بروتينات بسيطة ومعقدة
12. تمسخ البروتين ، عوامل تغيير الطبيعة
13. تجديد البروتين
حل المشاكل
"التنظيم الهيكلي للبروتينات وأساس عملها"
1. الوظيفة الرئيسية للبروتين - الهيموجلوبين A (HbA) - هي نقل الأكسجين إلى الأنسجة. في البشر ، تُعرف أشكال متعددة من هذا البروتين ذات الخصائص والوظائف المتغيرة - ما يسمى بالهيموغلوبين غير الطبيعي. على سبيل المثال ، وجد أن الهيموغلوبين S الموجود في كريات الدم الحمراء لمرضى فقر الدم المنجلي (HbS) لديهم قابلية منخفضة للذوبان في ظل ظروف انخفاض ضغط الأكسجين الجزئي (كما يحدث في الدم الوريدي). هذا يؤدي إلى تكوين مجاميع من هذا البروتين. يفقد البروتين وظيفته ، ويترسب ، وتصبح خلايا الدم الحمراء غير منتظمة (بعضها يشكل شكل منجل) ويتم تدميرها بشكل أسرع من المعتاد في الطحال. نتيجة لذلك ، يتطور فقر الدم المنجلي.
تم العثور على الاختلاف الوحيد في البنية الأولية لـ HvA في المنطقة الطرفية N من سلسلة من الهيموجلوبين. قارن بين المناطق الطرفية N في السلسلة β واعرض كيف تؤثر التغييرات في البنية الأولية للبروتين على خصائصه ووظائفه.
 لهذا:
لهذا:
أ) اكتب صيغ الأحماض الأمينية التي يختلف بها HvA ويقارن خصائص هذه الأحماض الأمينية (قطبية ، شحنة).
ب) استنتاج سبب انخفاض الذوبان وانتهاك نقل الأكسجين في الأنسجة.
2. يوضح الشكل مخططًا لهيكل البروتين الذي يحتوي على مركز ربط يجند (مركز نشط). اشرح لماذا يكون البروتين انتقائيًا في اختيار يجند. لهذا:
أ) تذكر ما هو المركز النشط للبروتين ، واعتبر بنية المركز النشط للبروتين الموضح في الشكل ؛
ب) كتابة صيغ جذور الأحماض الأمينية التي تشكل المركز النشط ؛
ج) ارسم رابطة يمكن أن تتفاعل على وجه التحديد مع الموقع النشط للبروتين. وضح عليها المجموعات الوظيفية القادرة على تكوين روابط مع جذور الأحماض الأمينية التي تشكل المركز النشط ؛
د) الإشارة إلى أنواع الروابط التي تنشأ بين الليجند وجذور الأحماض الأمينية للمركز النشط ؛
ه) اشرح الأساس لخصوصية تفاعل البروتين مع يجند.
 3.
يوضح الشكل الموقع النشط للبروتين والعديد من الروابط.
3.
يوضح الشكل الموقع النشط للبروتين والعديد من الروابط.
حدد أي من الروابط من المرجح أن يتفاعل مع الموقع النشط للبروتين ولماذا.
 ما هي أنواع الروابط التي تنشأ أثناء تكوين مركب بروتين - يجند؟
ما هي أنواع الروابط التي تنشأ أثناء تكوين مركب بروتين - يجند؟
4. يمكن استخدام النظائر الهيكلية لرباطات البروتين الطبيعي كأدوية لتغيير نشاط البروتينات.
الأسيتيل كولين هو وسيط لانتقال الإثارة في المشابك العصبية العضلية. عندما يتفاعل أستيل كولين مع البروتينات - مستقبلات الغشاء بعد المشبكي للعضلات الهيكلية ، تنفتح القنوات الأيونية ويحدث تقلص العضلات. الديثيلين دواء يستخدم في بعض العمليات لإرخاء العضلات ، حيث يعطل انتقال النبضات العصبية من خلال المشابك العصبية العضلية. اشرح آلية عمل الديثيلين كدواء مرخي للعضلات. لهذا:
أ) كتابة صيغ أسيتيل كولين وديثيلين ومقارنة بنيتها ؛
ب) وصف آلية عمل الاسترخاء للديثيلين.
5. في بعض الأمراض ترتفع درجة حرارة جسم المريض ، وهو ما يعتبر رد فعل وقائي للجسم. ومع ذلك ، فإن درجات الحرارة المرتفعة تضر ببروتينات الجسم. اشرح لماذا عند درجات حرارة أعلى من 40 درجة مئوية تتعطل وظيفة البروتينات وينشأ تهديد لحياة الإنسان. للقيام بذلك ، تذكر:
1) بنية البروتينات والروابط التي تحافظ على هيكلها في التشكل الأصلي ؛
2) كيف تتغير بنية ووظيفة البروتينات مع زيادة درجة الحرارة؟
3) ما هو الاستتباب ولماذا هو مهم للحفاظ على صحة الإنسان.
الوحدة المعيارية 2 البروتينات الأوليغوميرية كأهداف للتأثير التنظيمي. مجموعة متنوعة من البروتينات الهيكلية والوظيفية. طرق فصل البروتين وتنقيته
أهداف التعلم لتكون قادرًا على:
1. استخدم المعرفة حول سمات بنية ووظائف البروتينات قليلة القسيمات لفهم الآليات التكيفية لتنظيم وظائفها.
2. اشرح دور المرافقين في تركيب وصيانة تكوين البروتين في الخلية.
3. شرح تنوع مظاهر الحياة من خلال تنوع تراكيب ووظائف البروتينات المركبة في الجسم.
4. تحليل العلاقة بين بنية البروتينات ووظائفها من خلال مقارنة البروتينات الدموية ذات الصلة - الميوجلوبين والهيموجلوبين ، بالإضافة إلى ممثلي خمس فئات من البروتينات من عائلة الغلوبولين المناعي.
5. تطبيق المعرفة حول خصائص الخصائص الفيزيائية والكيميائية للبروتينات لاختيار طرق تنقيتها من البروتينات والشوائب الأخرى.
6. تفسير نتائج التركيب الكمي والنوعي لبروتينات بلازما الدم لتأكيد أو توضيح التشخيص السريري.
يعرف:
1. ملامح هيكل البروتينات قليلة القسيمات وآليات التكيف لتنظيم وظائفها على سبيل المثال الهيموجلوبين.
2. هيكل ووظائف المرافقين وأهميتها في الحفاظ على التكوين الأصلي للبروتينات في الخلية.
3. مبادئ تجميع البروتينات في عائلات حسب تشابه تكوينها ووظائفها على سبيل المثال من الغلوبولين المناعي.
4. طرق فصل البروتينات بناءً على خصائص خواصها الفيزيائية والكيميائية.
5. الرحلان الكهربائي لبلازما الدم كطريقة لتقييم التركيب النوعي والكمي للبروتينات.
الموضوع 1.4. ميزات هيكل وعمل البروتينات الأوليغومية على سبيل المثال الهيموغلوبين
1. تحتوي العديد من البروتينات على العديد من سلاسل عديد الببتيد. تسمى هذه البروتينات قليل القسيماتوالدوائر الفردية بروتومرات.ترتبط البروتومرات في البروتينات قليلة القسيمات بالعديد من الروابط غير التساهمية الضعيفة (الكارهة للماء ، الأيونية ، الهيدروجين). التفاعل
يتم تنفيذ protomers بفضل التكاملأسطح الاتصال الخاصة بهم.
يمكن أن يختلف عدد البروتومرات في البروتينات قليلة القسيمات اختلافًا كبيرًا: يحتوي الهيموغلوبين على 4 بروتومرات ، وإنزيم ناقلة أمين الأسبارتات - 12 بروتومرًا ، ويشتمل بروتين فيروس فسيفساء التبغ على 2120 بروتومرًا متصلًا بروابط غير تساهمية. لذلك ، يمكن أن تحتوي البروتينات قليلة القسيمات على أوزان جزيئية عالية جدًا.
يمكن اعتبار تفاعل أحد البروتومرات مع الآخرين كحالة خاصة لتفاعل البروتين مع يجند ، حيث يعمل كل بروتومر كجند لبروتومرات أخرى. يتم استدعاء عدد وطريقة اتصال البروتومرات في البروتين هيكل البروتين الرباعي.
يمكن أن تحتوي البروتينات على بروتومرات من نفس البنية أو بنية مختلفة ، على سبيل المثال ، homodimers عبارة عن بروتينات تحتوي على بروتومرين متطابقين ، و heterodimers عبارة عن بروتينات تحتوي على بروتومرين مختلفين.
إذا كانت البروتينات تحتوي على بروتومرات مختلفة ، فيمكن أن تتشكل عليها مراكز ربط بروابط مختلفة تختلف في التركيب. عندما يرتبط الارتباط بالمركز النشط ، تتجلى وظيفة هذا البروتين. يسمى المركز الموجود على بروتومر مختلف allosteric (بخلاف النشط). الاتصال يجند خيفي أو مؤثر ،يؤدي وظيفة تنظيمية (الشكل 1.18). يؤدي تفاعل المركز الخيفي مع المستجيب إلى تغيرات توافقية في بنية بروتين قليل القسيمات بأكمله بسبب قابليته للتوافق. يؤثر هذا على تقارب الموقع النشط لرابط معين وينظم وظيفة هذا البروتين. يسمى التغيير في تشكيل ووظيفة جميع البروتومرات أثناء تفاعل بروتين قليل القسيمات مع ليجند واحد على الأقل تغيير التشكل التعاوني. يتم استدعاء المستجيبات التي تعزز وظيفة البروتين المنشطاتوالمؤثرات التي تثبط وظيفتها - مثبطات.
وهكذا ، في البروتينات قليلة القسيمات ، وكذلك البروتينات التي لها بنية المجال ، تظهر خاصية جديدة مقارنة بالبروتينات الأحادية - القدرة على التنظيم الخيفي للوظائف (التنظيم عن طريق ربط روابط مختلفة بالبروتين). يمكن ملاحظة ذلك من خلال مقارنة هياكل ووظائف البروتينين المعقدين المرتبطين ارتباطًا وثيقًا ، وهما الميوغلوبين والهيموجلوبين.
 أرز. 1.18 رسم تخطيطي لهيكل البروتين الخافت
أرز. 1.18 رسم تخطيطي لهيكل البروتين الخافت
2. تشكيل الهياكل المكانية وعمل الميوجلوبين.
الميوغلوبين (Mb) هو بروتين موجود في العضلات الحمراء ، وتتمثل وظيفته الرئيسية في تكوين احتياطيات O 2 الضرورية للعمل العضلي المكثف. MB هو بروتين معقد يحتوي على جزء بروتين - apoMB وجزء غير بروتيني - الهيم. يحدد الهيكل الأساسي لـ apoMB شكله الكروي المضغوط وهيكل المركز النشط ، الذي يرتبط به الجزء غير البروتيني من الميوغلوبين ، الهيم. يرتبط الأكسجين من الدم إلى العضلات بالحديد + 2 الهيم في تكوين الميوجلوبين. MB هو بروتين أحادي ذو صلة عالية جدًا بـ O 2 ، لذلك يتم إطلاق الأكسجين بواسطة الميوغلوبين فقط أثناء العمل العضلي المكثف ، عندما ينخفض الضغط الجزئي لـ O 2 بشكل حاد.
تشكيل التشكل MB.في العضلات الحمراء ، على الريبوسومات أثناء الترجمة ، يحدث تخليق التركيب الأساسي لـ MB ، الذي يمثله تسلسل محدد من 153 من بقايا الأحماض الأمينية. يحتوي الهيكل الثانوي لـ Mv على ثمانية حلزونات α ، تسمى الأحرف اللاتينية من A إلى H ، والتي يوجد بينها أقسام غير حلزونية. البنية الثلاثية لـ Mv لها شكل كرة مضغوطة ، في تجويفها ، بين حلزونات F و E α ، يوجد مركز نشط (الشكل 1.19).
 أرز. 1.19 هيكل الميوجلوبين
أرز. 1.19 هيكل الميوجلوبين
3. ملامح هيكل وعمل المركز النشط MV.يتكون المركز النشط لـ Mv بشكل أساسي من جذور الأحماض الأمينية الكارهة للماء والتي تكون بعيدة عن بعضها البعض في الهيكل الأساسي (على سبيل المثال ، Tri 3 9 and Phen 138) يتم ربط الروابط ضعيفة الذوبان في الماء ، الهيم والأكسجين 2 ، بالمركز النشط. Heme هو رابط apoMv محدد (الشكل 1.20) ، يعتمد على أربع حلقات بيرول متصلة بجسور الميثينيل ؛ في المركز ، توجد ذرة Fe + 2 متصلة بذرات النيتروجين في حلقات البيرول بواسطة أربع روابط تنسيق. بالإضافة إلى الجذور الكارهة للماء للأحماض الأمينية ، يحتوي المركز النشط لـ Mv أيضًا على بقايا من اثنين من الأحماض الأمينية ذات الجذور المحبة للماء - جيس إي 7(جيس 64) و جيس إف 8(له 93) (الشكل 1.21).
 أرز. 1.20. هيكل الهيم - الجزء غير البروتيني من الميوغلوبين والهيموغلوبين
أرز. 1.20. هيكل الهيم - الجزء غير البروتيني من الميوغلوبين والهيموغلوبين
 أرز. 1.21. موقع الهيم و O 2 في الموقع النشط لبروتومرات الأبوميوغلوبين والهيموغلوبين
أرز. 1.21. موقع الهيم و O 2 في الموقع النشط لبروتومرات الأبوميوغلوبين والهيموغلوبين
يرتبط Heme تساهميًا بـ F 8 له عبر ذرة حديدية. يعلق O 2 بالحديد على الجانب الآخر من طائرة الهيم. يعد E 7 ضروريًا للتوجيه الصحيح لـ O 2 ويسهل إضافة الأكسجين إلى Fe + 2 heme
جيس إف 8يشكل رابطة تنسيق مع Fe + 2 ويصلح الهيم بحزم في المركز النشط. جيس إي 7ضروري للتوجيه الصحيح في المركز النشط لرابط آخر - O 2 أثناء تفاعله مع Fe + 2 heme. تخلق بيئة الهيم الدقيقة ظروفًا للارتباط القوي ولكن القابل للانعكاس لـ O 2 مع Fe + 2 وتمنع الماء من دخول المركز النشط المضاد للماء ، مما قد يؤدي إلى أكسدة Fe + 3.
يحدد التركيب الأحادي لـ MB ومركزه النشط التقارب العالي للبروتين لـ O 2.
4. هيكل القلة من الهيموغلوبين وتنظيم تقارب الهيموغلوبين لـ O 2 بواسطة الروابط. الهيموجلوبين البشري- عائلة من البروتينات وكذلك الميوجلوبين المرتبط بالبروتينات المعقدة (بروتينات الدم). لديهم هيكل رباعي وتحتوي على سلسلتين ألفا ، لكنهما يختلفان في هيكل السلاسل الأخرى متعددة الببتيد (2α- ، 2x- سلاسل). يحدد هيكل سلسلة البولي ببتيد الثانية ميزات عمل هذه الأشكال من Hb. حوالي 98٪ من الهيموجلوبين في كريات الدم الحمراء البالغة الهيموغلوبين أ(سلاسل 2α- ، 2p).
أثناء نمو الجنين ، هناك نوعان رئيسيان من الهيموجلوبين: HB الجنيني(2α ، 2ε) ، والتي توجد في المراحل المبكرة من نمو الجنين ، و الهيموغلوبين F (الجنين)- (2α ، 2γ) ، الذي يحل محل الهيموجلوبين الجنيني المبكر في الشهر السادس من نمو الجنين ويستبدل بـ Hb A فقط بعد الولادة.
Hv A هو بروتين مرتبط بالميوجلوبين (Mv) الموجود في كريات الدم الحمراء البالغة. يشبه هيكل البروتومرات الفردية بنية الميوغلوبين. الهياكل الثانوية والثالثية لبروتومرات الميوجلوبين والهيموجلوبين متشابهة جدًا ، على الرغم من حقيقة أن 24 من بقايا الأحماض الأمينية فقط متطابقة في الهيكل الأساسي لسلاسل البولي ببتيد الخاصة بهم (التركيب الثانوي لبروتومرات الهيموجلوبين ، مثل الميوجلوبين ، يحتوي على ثمانية حلزونات ألفا ، يُشار إليها بأحرف لاتينية من A إلى H ، والبنية الثلاثية لها شكل كرة مضغوطة). ولكن على عكس الميوغلوبين ، فإن الهيموغلوبين له بنية قليلة القسيمات ، ويتكون من أربعة سلاسل متعددة الببتيد متصلة بواسطة روابط غير تساهمية (الشكل 1.22).
يرتبط كل بروتومر Hb بجزء غير بروتيني - الهيم والبروتومرات المجاورة. إن ارتباط جزء البروتين من الهيموغلوبين مع الهيم يشبه ارتباط الميوجلوبين: في المركز النشط للبروتين ، تكون الأجزاء الكارهة للماء من الهيم محاطة بجذور الأحماض الأمينية الكارهة للماء ، باستثناء His F 8 و His E 7 ، والتي تقع على جانبي مستوى الهيم وتلعب دورًا مشابهًا في عمل البروتين وربطه بالأكسجين (انظر بنية الميوجلوبين).
 أرز. 1.22. هيكل قلة الدم للهيموجلوبين
أرز. 1.22. هيكل قلة الدم للهيموجلوبين
بجانب، جيس إي 7يؤدي مهمة دور إضافيفي أداء NV. يمتلك الهيم الحر تقاربًا أعلى بـ 25000 مرة من ثاني أكسيد الكربون مقارنة بـ O 2. يتشكل ثاني أكسيد الكربون بكميات صغيرة في الجسم ، ونظراً لارتفاع تقاربه مع الهيم ، فإنه يمكن أن يعطل نقل O 2 الضروري لحياة الخلية. ومع ذلك ، في تكوين الهيموجلوبين ، تتجاوز ألفة الهيم لأول أكسيد الكربون تقارب O 2 بمقدار 200 مرة فقط بسبب وجود E 7 في المركز النشط لـ His. تخلق بقايا هذا الحمض الأميني الظروف المثلى لربط الهيم بـ O2 ويضعف تفاعل الهيم مع ثاني أكسيد الكربون.
5. الوظيفة الرئيسية لـ Hb هي نقل O 2 من الرئتين إلى الأنسجة.على عكس الميوغلوبين الأحادي ، الذي له صلة عالية جدًا بـ O 2 ويقوم بوظيفة تخزين الأكسجين في العضلات الحمراء ، يوفر التركيب القليل للقليل من الهيموجلوبين:
1) التشبع السريع للهيموغلوبين بالأكسجين في الرئتين ؛
2) قدرة الهيموغلوبين على إطلاق الأكسجين في الأنسجة عند ضغط جزئي مرتفع نسبيًا من O 2 (20-40 ملم زئبق) ؛
3) إمكانية تنظيم انجذاب الهيموجلوبين إلى O 2.
6. تؤدي التغييرات التعاونية في تكوين بروتومرات الهيموجلوبين إلى تسريع ارتباط O 2 في الرئتين وعودته إلى الأنسجة. في الرئتين ، يؤدي الضغط الجزئي المرتفع لـ O2 إلى تعزيز ارتباطه بـ Hb في الموقع النشط لأربعة بروتومرات (2α و 2β). يقع المركز النشط لكل بروتومر ، كما هو الحال في الميوغلوبين ، بين حلزوني ألفا (F و E) في جيب كاره للماء. يحتوي على جزء غير بروتيني - الهيم ، مرتبطًا بجزء البروتين من خلال العديد من التفاعلات الضعيفة الكارهة للماء ورابطة قوية واحدة بين Fe 2 + heme وصاحب F 8 (انظر الشكل 1.21).
في deoxyhemoglobin ، بسبب هذا الارتباط مع صاحب F 8 ، تبرز ذرة Fe 2 + من مستوى الهيم باتجاه الهيستيدين. يحدث ارتباط O 2 مع Fe 2 + على الجانب الآخر من الهيم في منطقة His E 7 بمساعدة رابطة تنسيق حرة واحدة. يوفر له E 7 الظروف المثلى لربط O 2 بحديد الهيم.
تؤدي إضافة O 2 إلى ذرة Fe +2 لبروتومر واحد إلى انتقاله إلى مستوى الهيم ، وخلفه بقايا الهيستيدين المرتبطة به
 أرز. 1.23. تغيير في شكل بروتين الهيموجلوبين عند دمجه مع O 2
أرز. 1.23. تغيير في شكل بروتين الهيموجلوبين عند دمجه مع O 2
هذا يؤدي إلى تغيير في شكل جميع سلاسل البولي ببتيد بسبب قابليتها للتوافق. يؤدي تغيير شكل السلاسل الأخرى إلى تسهيل تفاعلها مع جزيئات O 2 التالية.
جزيء O2 الرابع يرتبط بالهيموجلوبين أسهل 300 مرة من الأول (الشكل 1.24).
 أرز. 1.24 التغييرات التعاونية في تشكيل بروتومرات الهيموجلوبين أثناء تفاعلها مع O 2
أرز. 1.24 التغييرات التعاونية في تشكيل بروتومرات الهيموجلوبين أثناء تفاعلها مع O 2
في الأنسجة ، يتم قطع كل جزيء O 2 تالٍ بسهولة أكبر من الجزيء السابق ، أيضًا بسبب التغيرات التعاونية في تشكيل البروتومر.
7. CO 2 و H + ، اللذان يتشكلان أثناء هدم المواد العضوية ، يقللان من تقارب الهيموجلوبين للأكسجين بما يتناسب مع تركيزهما. يتم إنتاج الطاقة اللازمة لعمل الخلية بشكل أساسي في الميتوكوندريا أثناء أكسدة المواد العضوية باستخدام O 2 المنبعث من الرئتين بواسطة الهيموجلوبين. نتيجة لأكسدة المواد العضوية ، تتشكل المنتجات النهائية لانحلالها: CO 2 و K 2 O ، وتتناسب كميتها مع شدة عمليات الأكسدة الجارية.
ينتشر ثاني أكسيد الكربون من الخلايا إلى الدم ويخترق كريات الدم الحمراء ، حيث يتحول إلى حمض الكربونيك تحت تأثير إنزيم الكربانهيدراز. يتفكك هذا الحمض الضعيف إلى بروتون وأيون بيكربونات.
H + قادرون على الانضمام إلى راديكالي GIS 14 6 في سلاسل α- و من الهيموجلوبين ، أي في مناطق بعيدة عن الهيم. تقلل بروتونات الهيموجلوبين من تقاربها مع O 2 ، وتعزز التخلص من O 2 من أوكسي Hb ، وتكوين deoxyHb ، وتزيد من إمداد الأنسجة بالأكسجين بما يتناسب مع عدد البروتونات المتكونة (الشكل 1.25).
تسمى الزيادة في كمية الأكسجين المحرر اعتمادًا على زيادة تركيز H + في كريات الدم الحمراء بتأثير بور (على اسم عالم الفيزيولوجيا الدنماركي كريستيان بور ، الذي اكتشف هذا التأثير لأول مرة).
في الرئتين ، يؤدي الضغط الجزئي المرتفع للأكسجين إلى تعزيز ارتباطه بـ deoxyHb ، مما يقلل من تقارب البروتين لـ H +. تتفاعل البروتونات المنبعثة تحت تأثير الكربانهيدراز مع البيكربونات لتكوين ثاني أكسيد الكربون و H 2 O

 أرز. 1.25. اعتماد تقارب Hb إلى O 2 على تركيز ثاني أكسيد الكربون والبروتونات (تأثير بوهر):
أرز. 1.25. اعتماد تقارب Hb إلى O 2 على تركيز ثاني أكسيد الكربون والبروتونات (تأثير بوهر):
لكن- تأثير تركيز ثاني أكسيد الكربون و H + على إطلاق O 2 من المركب مع Hb (تأثير بوهر) ؛ ب- أكسجة ديوكسي هيموغلوبين في الرئتين ، وتشكيل وإطلاق ثاني أكسيد الكربون.
يدخل ثاني أكسيد الكربون الناتج إلى الفضاء السنخي ويتم إزالته بهواء الزفير. وبالتالي ، يتم تنظيم كمية الأكسجين التي يطلقها الهيموجلوبين في الأنسجة من خلال منتجات تقويض المواد العضوية: فكلما زادت كثافة تحلل المواد ، على سبيل المثال ، أثناء المجهود البدني ، زاد تركيز ثاني أكسيد الكربون و H + والمزيد. الأكسجين الذي تتلقاه الأنسجة نتيجة لانخفاض ألفة H إلى O 2.
8. تنظيم خيفي لتقارب الهيموغلوبين لـ O 2 بواسطة يجند - 2،3-bisphosphoglycerate.في كريات الدم الحمراء ، يتم تصنيع الليجند الخيفي للهيموجلوبين ، 2،3-بيسفوسفوجليسيرات (2،3-BPG) ، من منتج أكسدة الجلوكوز - 1،3-بيسفوسفوغليسيرات. في ظل الظروف العادية ، يكون تركيز 2،3-BPG مرتفعًا ويمكن مقارنته بتركيز Hb. يحتوي 2،3-BPG على شحنة سالبة قوية تبلغ -5.
 يزيد البيسفوسفوجليسيرات في الشعيرات الدموية للأنسجة ، من خلال الارتباط بـ deoxyhemoglobin ، من إنتاج الأكسجين في الأنسجة ، مما يقلل من تقارب Hb إلى O 2.
يزيد البيسفوسفوجليسيرات في الشعيرات الدموية للأنسجة ، من خلال الارتباط بـ deoxyhemoglobin ، من إنتاج الأكسجين في الأنسجة ، مما يقلل من تقارب Hb إلى O 2.
يوجد تجويف في وسط جزيء الهيموجلوبين الرباعي. يتكون من بقايا الأحماض الأمينية لجميع البروتومرات الأربعة (انظر الشكل 1.22). في الشعيرات الدموية للأنسجة ، يكسر بروتون Hb (تأثير بوهر) الرابطة بين حديد الهيم و O 2. في جزيء
ديوكسي هيموغلوبين ، مقارنة مع أوكسي هيموغلوبين ، تظهر روابط أيونية إضافية تربط البروتومرات ، ونتيجة لذلك يزداد حجم التجويف المركزي مقارنة بالأوكسي هيموغلوبين. التجويف المركزي هو موقع ارتباط 2،3-BPG بالهيموجلوبين. نظرًا للاختلاف في حجم التجويف المركزي ، لا يمكن ربط 2،3-BPG إلا بـ deoxyhemoglobin.
يتفاعل 2،3-BPG مع الهيموجلوبين في منطقة بعيدة عن المواقع النشطة للبروتين وينتمي إليها خيفيالروابط (التنظيمية) ، والتجويف المركزي Hb هو مركز خيفي.يحتوي 2،3-BPG على شحنة سالبة قوية ويتفاعل مع خمس مجموعات موجبة الشحنة من سلسلتي Hb: مجموعة N-terminal α-amino Val و Lys 82 Gis 143 جذور (الشكل 1.26).
 أرز. 1.26 BPG في التجويف المركزي لـ deoxyhemoglobin
أرز. 1.26 BPG في التجويف المركزي لـ deoxyhemoglobin
يرتبط BPG بثلاث مجموعات موجبة الشحنة في كل حبلا.
في الشعيرات الدموية للأنسجة ، يتفاعل deoxyhemoglobin الناتج مع 2،3-BPG ، وتتشكل الروابط الأيونية بين الجذور الموجبة الشحنة من سلاسل β و ligand سالبة الشحنة ، مما يغير تكوين البروتين ويقلل من تقارب Hb لـ O 2. يساهم انخفاض تقارب Hb لـ O 2 في إطلاق أكثر كفاءة لـ O 2 في الأنسجة.
في الرئتين ، عند الضغط الجزئي المرتفع ، يتفاعل الأكسجين مع الهيموغلوبين ، لينضم إلى حديد الهيم ؛ في هذه الحالة ، يتغير شكل البروتين ، ويقل التجويف المركزي ، ويتم إزاحة 2،3-BPG من المركز الخيفي
وبالتالي ، فإن البروتينات قليلة القسيمات لها خصائص جديدة مقارنة بالبروتينات الأحادية. إرفاق الروابط في المواقع ،
بعيدة مكانياً عن بعضها البعض (خيفي) ، قادرة على إحداث تغييرات توافقية في جزيء البروتين بأكمله. بسبب التفاعل مع الروابط التنظيمية ، يتغير التشكل ووظيفة جزيء البروتين تتكيف مع التغيرات البيئية.
الموضوع 1.5. الحفاظ على التوافق الطبيعي للبروتينات في ظروف الخلايا
في الخلايا ، أثناء تخليق سلاسل البولي ببتيد ، يتم نقلها عبر الأغشية إلى الأقسام المقابلة من الخلية ، وفي عملية الطي (تكوين تشكيل أصلي) وأثناء تجميع البروتينات قليلة القسيمات ، وكذلك أثناء عملها ، ، عرضة للتجميع ، والتطابقات غير المستقرة تنشأ في بنية البروتين. تظهر الجذور الكارهة للماء ، المخبأة عادةً داخل جزيء البروتين في شكلها الأصلي ، على السطح في شكل غير مستقر وتميل إلى الاندماج مع مجموعات من البروتينات الأخرى التي تكون ضعيفة الذوبان في الماء بالمثل. في خلايا جميع الكائنات الحية المعروفة ، تم العثور على بروتينات خاصة توفر طيًا مثاليًا لبروتينات الخلية ، وتثبّت شكلها الأصلي أثناء العمل ، والأهم من ذلك أنها تحافظ على بنية ووظائف البروتينات داخل الخلايا في حالة اضطراب التوازن. تسمى هذه البروتينات "المرافقون"وهو ما يعني "مربية" بالفرنسية.
1. المرافقات الجزيئية ودورها في منع تمسخ البروتين.
يتم تصنيف المرافقين (III) وفقًا لكتلة الوحدات الفرعية. المرافقات ذات الوزن الجزيئي العالي لها كتلة من 60 إلى 110 كيلو دالتون. من بينها ، تمت دراسة ثلاثة فصول أكثر: Sh-60 و Sh-70 و Sh-90. يتضمن كل فئة عائلة من البروتينات ذات الصلة. وهكذا ، يحتوي Sh-70 على بروتينات بوزن جزيئي من 66 إلى 78 كيلو دالتون. المرافقات ذات الوزن الجزيئي المنخفض لها وزن جزيئي يتراوح من 40 إلى 15 كيلو دالتون.
من بين المرافقين هناك التأسيسيالبروتينات التي لا يعتمد تركيبها الأساسي العالي على التأثيرات المجهدة لخلايا الجسم ، و محرضيكون تركيبها ضعيفًا في ظل الظروف العادية ، لكنه يزداد بشكل حاد تحت التأثيرات المجهدة. تسمى المرافق المحفزة أيضًا "بروتينات الصدمة الحرارية" لأنها اكتشفت لأول مرة في الخلايا المعرضة لدرجات حرارة عالية. في الخلايا ، بسبب التركيز العالي للبروتينات ، يصعب التجديد التلقائي للبروتينات المشوهة جزئيًا. يمكن أن يمنع Sh-70 عملية التمسخ التي بدأت والمساعدة في استعادة التكوين الأصلي للبروتينات. المرافق الجزيئية - 70- فئة من البروتينات محفوظة بدرجة عالية في جميع أجزاء الخلية: السيتوبلازم ، النواة ، الشبكة الإندوبلازمية ، الميتوكوندريا. في نهاية الكربوكسيل لسلسلة البولي ببتيد الوحيدة لـ Sh-70 ، توجد منطقة عبارة عن أخدود يمكن أن يتفاعل مع الببتيدات ذات الطول
من 7 إلى 9 من مخلفات الأحماض الأمينية المخصبة بجذور كارهة للماء. تحدث هذه المواقع في البروتينات الكروية تقريبًا كل 16 حمضًا أمينيًا. Sh-70 قادر على حماية البروتينات من التعطيل الحراري واستعادة تشكيل ونشاط البروتينات المشوهة جزئيًا.
2. دور المرافقين في طي البروتين.أثناء تخليق البروتينات على الريبوسوم ، يتم تصنيع المنطقة الطرفية N لبولي ببتيد قبل المنطقة الطرفية C. مطلوب تسلسل الأحماض الأمينية الكاملة للبروتين لتشكيل التشكل الأصلي. في عملية تخليق البروتين ، يمكن لـ chaperones-70 ، نظرًا لهيكل مركزها النشط ، تغطية مواقع البولي ببتيد المعرضة للتجميع المخصب بجذور الأحماض الأمينية الكارهة للماء حتى اكتمال التوليف (الشكل 1.27 ، أ).
 أرز. 1.27 مشاركة المرافقين في طي البروتين
أرز. 1.27 مشاركة المرافقين في طي البروتين
أ - مشاركة chaperones-70 في منع التفاعلات الكارهة للماء بين مواقع البولي ببتيد المركب ؛ ب - تكوين تكوين البروتين الأصلي في مجمع تشابيرون
يتم طي العديد من البروتينات عالية الوزن الجزيئي ذات التشكل المعقد ، مثل بنية المجال ، في مساحة خاصة تكونت بواسطة W-60. Sh-60تعمل كمركب قليل القسيمات يتكون من 14 وحدة فرعية. إنها تشكل حلقتين مجوفتين ، كل منهما تتكون من سبع وحدات فرعية ، هذه الحلقات متصلة ببعضها البعض. تتكون كل وحدة فرعية من III-60 من ثلاثة مجالات: قمي (قمي) ، مخصب بجذور كارهة للماء التي تواجه تجويف الحلقة ، وسيطة واستوائية (الشكل 1.28).
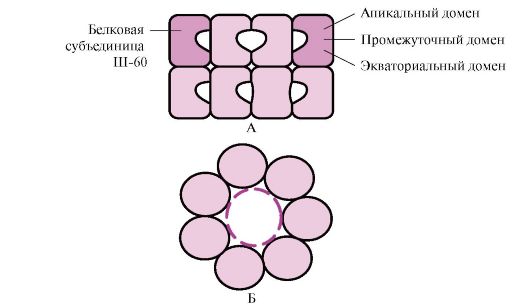 أرز. 1.28 يتكون هيكل مجمع تشبيرونين من 14 ش -60
أرز. 1.28 يتكون هيكل مجمع تشبيرونين من 14 ش -60
أ - منظر جانبي ب - منظر علوي
تدخل البروتينات المركبة مع العناصر السطحية المميزة للجزيئات غير المطوية ، على وجه الخصوص ، الجذور الكارهة للماء ، في تجويف حلقات المرافقة. في البيئة المحددة لهذه التجاويف ، يتم تعداد المطابقات المحتملة حتى يتم العثور على الشكل الوحيد الأكثر ملاءمة للطاقة (الشكل 1.27 ، ب). يكون تكوين المطابقات وإطلاق البروتين مصحوبًا بتحلل ATP المائي في المنطقة الاستوائية. عادةً ما يتطلب هذا الطي المعتمد على الوصيف قدرًا كبيرًا من الطاقة.
بالإضافة إلى المشاركة في تكوين البنية ثلاثية الأبعاد للبروتينات وإعادة تنشيط البروتينات المشوهة جزئيًا ، فإن المرافقات ضرورية أيضًا للعمليات الأساسية مثل تجميع البروتينات قليلة القسيمات ، والتعرف على البروتينات المشوهة ونقلها إلى الليزوزومات ، ونقل البروتينات من خلال الأغشية ، والمشاركة في تنظيم نشاط مجمعات البروتين.
الموضوع 1.6. مجموعة متنوعة من البروتينات. أسر البروتين على سبيل المثال الجلوبيولين المناعي
1. تلعب البروتينات دورًا حاسمًا في حياة الخلايا الفردية والكائن متعدد الخلايا بأكمله ، ووظائفها متنوعة بشكل مدهش. يتم تحديد ذلك من خلال خصائص البنية الأساسية وتشكيلات البروتينات ، والبنية الفريدة للمركز النشط ، والقدرة على ربط روابط محددة.
فقط جزء صغير جدًا من جميع المتغيرات المحتملة لسلاسل الببتيد يمكن أن يتبنى بنية مكانية مستقرة ؛ غالبية
يمكن أن يأخذ منهم العديد من المطابقات مع نفس طاقة جيبس تقريبًا ، ولكن بخصائص مختلفة. يوفر الهيكل الأساسي لمعظم البروتينات المعروفة ، والذي تم اختياره بواسطة التطور البيولوجي ، ثباتًا استثنائيًا لأحد التطابقات ، والذي يحدد ميزات عمل هذا البروتين.
2. عائلات البروتين.داخل نفس الأنواع البيولوجية ، يمكن أن تؤدي بدائل بقايا الأحماض الأمينية إلى ظهور بروتينات مختلفة تؤدي وظائف ذات صلة ولها تسلسل أحماض أمينية متماثلة. مثل هذه البروتينات ذات الصلة لها تشابه لافت للنظر: عدد وترتيب حلزونات α و / أو هياكل ، ومعظم المنعطفات والطيات في سلاسل البولي ببتيد متشابهة أو متطابقة. يتم عزل البروتينات ذات المناطق المتجانسة من سلسلة البولي ببتيد والتشكيل المتشابه والوظائف ذات الصلة في عائلات بروتينية. أمثلة على عائلات البروتين: بروتينات السيرين ، عائلة الغلوبولين المناعي ، عائلة الميوغلوبين.
بروتينات سيرين- عائلة من البروتينات تؤدي وظيفة الإنزيمات المحللة للبروتين. وتشمل هذه الإنزيمات الهضمية - كيموتربسين ، التربسين ، الإيلاستاز والعديد من عوامل تخثر الدم. تحتوي هذه البروتينات على 40٪ من الأحماض الأمينية المتطابقة وتشكل مشابه جدًا (الشكل 1.29).

أرز. 1.29 الهياكل المكانية للإيلاستاز (أ) وكيموتريبسين (ب)
أدت بعض بدائل الأحماض الأمينية إلى تغيير في خصوصية الركيزة لهذه البروتينات وظهور التنوع الوظيفي داخل الأسرة.
3. عائلة الغلوبولين المناعي.تلعب بروتينات عائلة الغلوبولين المناعي ، التي تضم ثلاث عائلات بروتينية ، دورًا كبيرًا في عمل الجهاز المناعي:
الأجسام المضادة (الغلوبولين المناعي) ؛
مستقبلات الخلايا اللمفاوية التائية.
بروتينات مجمع التوافق النسيجي الرئيسي - الفئتان الأولى والثانية من MHC (مجمع التوافق النسيجي الرئيسي).
كل هذه البروتينات لها بنية مجال ، وتتكون من مجالات شبيهة بالمناعة وتؤدي وظائف مماثلة: فهي تتفاعل مع بنى غريبة ، إما مذابة في الدم ، أو السائل الليمفاوي أو بين الخلايا (الأجسام المضادة) ، أو تقع على سطح الخلايا (تمتلك أو أجنبي).
4. الأجسام المضادة- بروتينات محددة تنتجها الخلايا الليمفاوية B استجابةً لابتلاع بنية غريبة تسمى مولد المضاد.
ملامح هيكل الأجسام المضادة
أبسط جزيئات الأجسام المضادة تتكون من أربع سلاسل متعددة الببتيد: سلسلتان خفيفتان متطابقتان - L ، تحتويان على حوالي 220 من الأحماض الأمينية ، وسلسلتين ثقيلتين متطابقتين - H ، وتتكون من 440-700 من الأحماض الأمينية. ترتبط جميع السلاسل الأربعة في جزيء الجسم المضاد بالعديد من الروابط غير التساهمية وأربعة روابط ثاني كبريتيد (الشكل 1.30).
تتكون السلاسل الخفيفة للأجسام المضادة من مجالين: متغير (VL) ، يقع في المنطقة الطرفية N لسلسلة بولي ببتيد ، وثابت (CL) ، يقع عند الطرف C. تحتوي السلاسل الثقيلة عادةً على أربعة مجالات: متغير واحد (VH) عند الطرف N وثلاثة ثوابت (CH1 ، CH2 ، CH3) (انظر الشكل 1.30). يحتوي كل مجال من مجالات الغلوبولين المناعي على بنية فوقية مطوية حيث يتم ربط اثنين من بقايا السيستين بواسطة رابطة ثاني كبريتيد.
بين المجالين الثابتين CH1 و CH2 توجد منطقة تحتوي على عدد كبير من مخلفات البرولين ، والتي تمنع تكوين البنية الثانوية وتفاعل سلاسل H المجاورة في هذا الجزء. تعطي منطقة المفصلة مرونة جزيء الجسم المضاد. بين المجالات المتغيرة للسلاسل الثقيلة والخفيفة يوجد موقعان متطابقان لربط مولد الضد (مواقع نشطة لمولدات الضد الرابطة) ، لذلك غالبًا ما تسمى هذه الأجسام المضادة ثنائي التكافؤ.لا يتضمن ارتباط مولد الضد بجسم مضاد كامل تسلسل الأحماض الأمينية للمناطق المتغيرة لكلتا السلسلتين ، ولكن فقط 20-30 من الأحماض الأمينية الموجودة في المناطق شديدة التغير لكل سلسلة. هذه المناطق هي التي تحدد القدرة الفريدة لكل نوع من الأجسام المضادة على التفاعل مع المستضد التكميلي المقابل.
الأجسام المضادة هي أحد خطوط دفاع الجسم ضد غزو الكائنات الغريبة. يمكن تقسيم عملها إلى مرحلتين: المرحلة الأولى هي التعرف على مستضد وربطه على سطح الكائنات الغريبة ، وهو أمر ممكن بسبب وجود مواقع ارتباط بمولد الضد في بنية الجسم المضاد ؛ المرحلة الثانية هي بدء عملية تعطيل وتدمير المستضد. تعتمد خصوصية المرحلة الثانية على فئة الأجسام المضادة. هناك خمس فئات من السلاسل الثقيلة التي تختلف عن بعضها البعض في بنية المجالات الثابتة: α و و ε و γ و μ ، والتي بموجبها يتم تمييز خمس فئات من الغلوبولين المناعي: A و D و E و G و M.
تمنح السمات الهيكلية للسلاسل الثقيلة مناطق المفصلات والمناطق الطرفية C للسلاسل الثقيلة خاصية تشكيل مميزة لكل فئة. بمجرد ارتباط المستضد بجسم مضاد ، فإن التغييرات التوافقية في المجالات الثابتة تحدد مسار إزالة المستضد.
 أرز. 1. 30. هيكل المجال من IgG
أرز. 1. 30. هيكل المجال من IgG
الغلوبولين المناعي M.
الجلوبولينات المناعية M لها شكلين.
شكل أحادي- الصنف الأول من الأجسام المضادة التي تنتجها الخلايا اللمفاوية البائية النامية. بعد ذلك ، تتحول العديد من الخلايا البائية إلى إنتاج فئات أخرى من الأجسام المضادة ، ولكن مع نفس موقع الارتباط بمولد الضد. تم دمج IgM في الغشاء ويعمل كمستقبل للتعرف على المستضد. يمكن دمج IgM في غشاء الخلية بسبب وجود 25 بقايا من الأحماض الأمينية الكارهة للماء في الجزء الخلفي من المنطقة.
شكل إفرازي من IgMيحتوي على خمس وحدات فرعية أحادية مرتبطة ببعضها البعض بواسطة روابط ثاني كبريتيد وسلسلة J إضافية متعددة الببتيد (الشكل 1.31). لا تحتوي مونومرات السلسلة الثقيلة من هذا الشكل على ذيل كاره للماء. يحتوي pentamer على 10 مواقع مرتبطة بمولد الضد ، وبالتالي فهو فعال في التعرف على المستضد الذي دخل الجسم وإزالته لأول مرة. الشكل الإفرازي لـ IgM هو الفئة الرئيسية للأجسام المضادة التي تفرز في الدم أثناء الاستجابة المناعية الأولية. يؤدي ارتباط IgM إلى مستضد إلى تغيير شكل IgM ويحفز ارتباطه بمكون البروتين الأول للنظام التكميلي (النظام المتمم عبارة عن مجموعة من البروتينات التي تشارك في تدمير المستضد) وتفعيل هذا النظام. إذا كان المستضد موجودًا على سطح الكائن الدقيق ، فإن النظام التكميلي يسبب انتهاكًا لسلامة غشاء الخلية وموت الخلية البكتيرية.
الغلوبولين المناعي G
من الناحية الكمية ، تسود هذه الفئة من الغلوبولين المناعي في الدم (75٪ من إجمالي Ig). IgG - مونومرات ، وهي الفئة الرئيسية من الأجسام المضادة التي تفرز في الدم أثناء الاستجابة المناعية الثانوية. بعد تفاعل IgG مع المستضدات السطحية للكائنات الحية الدقيقة ، يكون مركب الجسم المضاد والمستضد قادرًا على ربط وتنشيط بروتينات النظام التكميلي أو يمكن أن يتفاعل مع مستقبلات معينة على البلاعم والعدلات. التفاعل مع البالعات
 أرز. 1.31. هيكل الشكل الإفرازي لـ IgM
أرز. 1.31. هيكل الشكل الإفرازي لـ IgM
لامتصاص معقدات الأجسام المضادة للمستضد وتدميرها في بلعمات الخلايا. IgG هو الفئة الوحيدة من الأجسام المضادة التي يمكنها عبور حاجز المشيمة وحماية الجنين من العدوى في الرحم.
الغلوبولين المناعي أ
الصنف الرئيسي من الأجسام المضادة الموجودة في الإفرازات (اللبن ، اللعاب ، إفرازات الجهاز التنفسي والأمعاء). يُفرز IgA بشكل أساسي في صورة خافتة ، حيث ترتبط المونومرات ببعضها البعض من خلال سلسلة J إضافية (الشكل 1.32).
لا يتفاعل IgA مع النظام التكميلي والخلايا البلعمية ، ولكن من خلال الارتباط بالكائنات الدقيقة ، تمنع الأجسام المضادة من الالتصاق بالخلايا الظهارية والاختراق في الجسم.
الغلوبولين المناعي E.
يتم تمثيل الغلوبولين المناعي E بواسطة المونومرات التي تحتوي فيها سلاسل الثقيلة ، بالإضافة إلى سلاسل μ من الغلوبولين المناعي M ، ومجالات متغيرة واحدة وأربعة مجالات ثابتة. IgE بعد إفراز الارتباط مع الخاصة بهم
 أرز. 1.32. هيكل IgA
أرز. 1.32. هيكل IgA
المناطق الطرفية C مع المستقبلات المقابلة على سطح الخلايا البدينة والخلايا القاعدية. ونتيجة لذلك ، فإنها تصبح مستقبلات لمولدات المضادات على سطح هذه الخلايا (الشكل 1.33).
 أرز. 1.33 تفاعل IgE مع مستضد على سطح الخلية البدينة
أرز. 1.33 تفاعل IgE مع مستضد على سطح الخلية البدينة
بعد توصيل المستضد بمواقع IgE المرتبطة بالمستضد المقابلة ، تتلقى الخلايا إشارة لإفراز مواد نشطة بيولوجيًا (هيستامين ، سيروتونين) ، والتي تعتبر مسؤولة إلى حد كبير عن تطور تفاعل التهابي وعن ظهور ردود فعل تحسسية مثل الربو والشرى وحمى القش.
الغلوبولين المناعي د
تم العثور على الغلوبولين المناعي D في مصل الدم بكميات صغيرة جدًا ، فهي مونومرات. تحتوي السلاسل الثقيلة على ثلاثة مجالات متغيرة وثابتة. يعمل IgD كمستقبلات للخلايا اللمفاوية B ، ولا تزال الوظائف الأخرى غير معروفة. يؤدي تفاعل مستضدات معينة مع مستقبلات على سطح الخلايا الليمفاوية البائية (IgD) إلى نقل هذه الإشارات إلى الخلية وتفعيل الآليات التي تضمن تكاثر هذه الخلايا الليمفاوية.
الموضوع 1.7. الخصائص الفيزيائية والكيميائية للبروتينات وطرق فصلها
1. تختلف البروتينات الفردية في خصائصها الفيزيائية والكيميائية:
شكل الجزيئات
الوزن الجزيئي الغرامي؛
الشحنة الإجمالية ، التي تعتمد قيمتها على نسبة المجموعات الأنيونية والكاتيونية من الأحماض الأمينية ؛
نسبة جذور الأحماض الأمينية القطبية وغير القطبية على سطح الجزيئات ؛
درجات المقاومة لعوامل تغيير طبيعة مختلفة.
2. ذوبان البروتينات يعتمدعلى خصائص البروتينات المذكورة أعلاه ، وكذلك على تكوين الوسط الذي يذوب فيه البروتين (قيم الأس الهيدروجيني ، وتكوين الملح ، ودرجة الحرارة ، ووجود المواد العضوية الأخرى التي يمكن أن تتفاعل مع البروتين). يعد حجم شحنة جزيئات البروتين أحد العوامل التي تؤثر على قابليتها للذوبان. عندما تُفقد الشحنة عند النقطة الكهربية ، تتجمع البروتينات وترسب بسهولة أكبر. هذا ينطبق بشكل خاص على البروتينات المشوهة ، التي تحتوي على جذور أحماض أمينية كارهة للماء على السطح.
على سطح جزيء البروتين ، توجد جذور أحماض أمينية موجبة وسالبة الشحنة. يعتمد عدد هذه المجموعات ، وبالتالي الشحنة الكلية للبروتينات ، على الرقم الهيدروجيني للوسط ، أي نسبة تركيز مجموعات H + و OH. في بيئة حمضيةتؤدي زيادة تركيز H + إلى قمع تفكك مجموعات الكربوكسيل -COO - + H +> -COOH وانخفاض الشحنة السالبة للبروتينات. في بيئة قلوية ، يؤدي ارتباط OH - البروتونات الزائدة التي تشكلت أثناء تفكك المجموعات الأمينية - NH 3 + + OH - - NH 2 + H 2 O مع تكوين الماء ، إلى انخفاض في الشحنة الإيجابية للبروتينات. يتم استدعاء قيمة الرقم الهيدروجيني التي يكون عندها البروتين صافي شحنة صفر النقطة الكهروضوئية (IEP).في IET ، يكون عدد المجموعات المشحونة إيجابًا وسلبًا هو نفسه ، أي البروتين في حالة متساوية الكهرباء.
3. فصل البروتينات الفردية.تعتمد ميزات بنية الجسم وعمله على مجموعة البروتينات التي يتم تصنيعها فيه. من المستحيل دراسة بنية وخصائص البروتينات دون عزلها عن الخلية وتنقيتها من البروتينات الأخرى والجزيئات العضوية. مراحل عزل وتنقية البروتينات الفردية:
تدمير الخليةمن الأنسجة المدروسة والحصول على المجانسة.
فصل المجانسة إلى كسورالطرد المركزي ، والحصول على جزء نووي أو ميتوكوندريا أو عصاري خلوي أو جزء آخر يحتوي على البروتين المطلوب.
تمسخ الحرارة الانتقائي- التسخين قصير المدى لمحلول البروتين ، حيث يمكن إزالة جزء من شوائب البروتين المشوهة (في حالة استقرار البروتين نسبيًا).
يملح.تترسب البروتينات المختلفة بتركيزات مختلفة من الملح في المحلول. عن طريق زيادة تركيز الملح تدريجيًا ، من الممكن الحصول على عدد من الأجزاء الفردية ذات المحتوى السائد من البروتين المفرز في إحداها. تجزئة البروتينات الأكثر استخدامًا هي كبريتات الأمونيوم. تترسب البروتينات ذات أقل قابلية للذوبان عند تركيزات منخفضة من الملح.
هجوم العمالقه- طريقة غربلة الجزيئات من خلال حبيبات Sephadex المنتفخة (سلاسل عديد السكاريد ديكستران ثلاثية الأبعاد مع المسام). سيعتمد معدل مرور البروتينات عبر عمود مملوء بـ Sephadex على وزنها الجزيئي: فكلما كانت كتلة جزيئات البروتين أصغر ، كلما كان اختراقها أسهل في الحبيبات وظلت هناك لفترة أطول ، وكلما كانت الكتلة أكبر ، زادت سرعة استخلاصها من الحبيبات. عمودي.
تنبيذ فائق- طريقة تتكون من حقيقة أن البروتينات في أنبوب الطرد المركزي توضع في الجزء الدوار لجهاز طرد مركزي فائق. عندما يدور الجزء المتحرك ، يكون معدل ترسيب البروتينات متناسبًا مع وزنها الجزيئي: توجد أجزاء من البروتينات الثقيلة بالقرب من قاع الأنبوب ، وتكون الأجزاء الأخف أقرب إلى السطح.
الكهربائي- طريقة تعتمد على الفروق في سرعة حركة البروتينات في مجال كهربائي. هذه القيمة تتناسب مع شحنة البروتينات. يتم إجراء الفصل الكهربي للبروتين على الورق (في هذه الحالة ، يكون معدل حركة البروتين متناسبًا فقط مع شحنتها) أو في هلام بولي أكريلاميد بحجم مسام معين (معدل حركة البروتينات يتناسب مع شحنتها ووزنها الجزيئي ).
كروماتوغرافيا التبادل الأيوني- طريقة تجزئة تعتمد على ارتباط مجموعات البروتينات المؤينة مع مجموعات مشحونة بشكل معاكس من راتنجات التبادل الأيوني (مواد بوليمرية غير قابلة للذوبان). تتناسب قوة ارتباط البروتين بالراتنج مع شحنة البروتين. يمكن غسل البروتينات الممتصة على بوليمر التبادل الأيوني بتركيزات متزايدة من محاليل كلوريد الصوديوم ؛ كلما انخفضت شحنة البروتين ، كلما انخفض تركيز كلوريد الصوديوم لإزالة البروتين المرتبط بالمجموعات الأيونية للراتنج.
اللوني تقارب- الطريقة الأكثر تحديدًا لعزل البروتينات الفردية ، حيث يتم ربط رابطة من البروتين تساهميًا ببوليمر خامل. عندما يتم تمرير محلول بروتين من خلال عمود به بوليمر ، بسبب الارتباط التكميلي للبروتين بالرابط ، يتم فقط امتصاص البروتين الخاص بهذا المركب في العمود.
غسيل الكلى- طريقة مستخدمة لإزالة المركبات ذات الوزن الجزيئي المنخفض من محلول بروتين معزول. تعتمد الطريقة على عدم قدرة البروتينات على المرور عبر غشاء نصف نافذ ، على عكس المواد ذات الوزن الجزيئي المنخفض. يتم استخدامه لتنقية البروتينات من الشوائب ذات الوزن الجزيئي المنخفض ، على سبيل المثال ، من الأملاح بعد التمليح.
التعيينات لأعمال الاستخلاص
1. املأ الجدول. 1.4
الجدول 1.4. تحليل مقارن لهيكل ووظائف البروتينات ذات الصلة - الميوجلوبين والهيموجلوبين
أ) تذكر بنية المركز النشط Mb و Hb. ما الدور الذي تلعبه الجذور الكارهة للماء للأحماض الأمينية في تكوين المراكز النشطة لهذه البروتينات؟ وصف هيكل المركز النشط Mb و Hb وآليات ارتباط الترابط به. ما الدور الذي تلعبه مخلفاته من F 8 و E 7 في عمل الموقع النشط Mv و Hv؟
ب) ما هي الخصائص الجديدة التي يمتلكها الهيموغلوبين مقارنةً بالميوغلوبين الأحادي المرتبط به؟ اشرح دور التغييرات التعاونية في تشكيل البروتومرات في جزيء الهيموجلوبين ، وتأثير ثاني أكسيد الكربون وتركيزات البروتون على تقارب الهيموجلوبين مع الأكسجين ، ودور 2،3-BPG في التنظيم الخيفي لوظيفة الهيموجلوبين.
2. وصف خصائص المرافق الجزيئية ، مع الانتباه إلى العلاقة بين هيكلها ووظيفتها.
3. ما هي البروتينات التي يتم تجميعها في العائلات؟ باستخدام مثال عائلة الغلوبولين المناعي ، حدد السمات الهيكلية المماثلة والوظائف ذات الصلة لبروتينات هذه العائلة.
4. في كثير من الأحيان ، البروتينات الفردية المنقاة مطلوبة للتطبيقات البيوكيميائية والطبية. اشرح ما هي الخصائص الفيزيائية والكيميائية للبروتينات التي تعتمد عليها الطرق المستخدمة لفصلها وتنقيتها.
مهام التحكم الذاتي
1. اختر الإجابات الصحيحة.
وظائف الهيموجلوبين:
A. O 2 النقل من الرئتين إلى الأنسجة B. H + النقل من الأنسجة إلى الرئتين
ب- الحفاظ على درجة حموضة ثابتة في الدم. د- نقل ثاني أكسيد الكربون من الرئتين إلى الأنسجة
د- نقل ثاني أكسيد الكربون من الأنسجة إلى الرئتين
2. اختر الإجابات الصحيحة. يجندα -بروتومر Hb هو:أ. هيم
B. الأكسجين
ب. CO D. 2،3-BPG
D. β- بروتومير
3. اختر الإجابات الصحيحة.
يختلف الهيموغلوبين عن الميوغلوبين:
A. لديها هيكل رباعي
يتم تمثيل الهيكل الثانوي فقط بواسطة α-helices
B. يشير إلى البروتينات المعقدة
D. يتفاعل مع ligand خيفي D. مرتبط تساهميًا بالهيم
4. اختر الإجابات الصحيحة.
تقارب Hb لـ O 2 ينخفض:
A. عندما يتم ربط جزيء O 2 واحد. عندما يتم التخلص من جزيء O 2
B. عند التفاعل مع 2،3-BPG
D. عندما تعلق على protomers H + D. عندما ينخفض تركيز 2،3-BPG
5. اضبط المباراة.
بالنسبة لأنواع Hb فهي مميزة:
أ. تشكل مجاميع ليفية في شكل ديوكسي ب. تحتوي على سلسلتين ألفا واثنين من سلاسل ألفا
B. الشكل السائد لـ Hb في كريات الدم الحمراء البالغة D. يحتوي على الهيم مع Fe + 3 في المركز النشط
D. يحتوي على سلسلتين α- واثنين 1. HvA 2.
6. اضبط المباراة.
Ligands Hb:
A. يرتبط Hb في مركز allosteric
B. لديه انجذاب كبير جدا للموقع النشط Hb
يؤدي الانضمام إلى زيادة تقارب الهيموغلوبين مع O 2 D. يؤكسد Fe + 2 إلى Fe + 3
د- يشكل رابطة تساهمية مع hysF8
7. اختر الإجابات الصحيحة.
المرافقون:
A. البروتينات موجودة في جميع أجزاء الخلية
ب. تم تعزيز التوليف تحت التأثيرات المجهدة
ب. المشاركة في التحلل المائي للبروتينات المشوهة
D. المشاركة في الحفاظ على التكوين الأصلي للبروتينات
د- إنشاء عضيات يتشكل فيها تكوين البروتين
8. المباراة. المناعية:
A. الشكل الإفرازي هو خماسي
فئة Ig التي تعبر حاجز المشيمة
مستقبلات الخلايا البدينة Ig - Mast cell receptor
د- الصنف الرئيسي من Ig موجود في إفرازات الخلايا الظهارية. مستقبلات الخلايا الليمفاوية B ، والتي يؤدي تفعيلها إلى ضمان تكاثر الخلايا
9. اختر الإجابات الصحيحة.
الغلوبولين المناعي E:
A. التي تنتجها الضامة B. لها سلاسل ε الثقيلة.
B. جزءا لا يتجزأ من غشاء الخلايا اللمفاوية التائية
د- تعمل كمستقبلات غشائية لمولدات المضادات على الخلايا البدينة والخلايا القاعدية
د- مسئول عن ظهور تفاعلات الحساسية
10. اختر الإجابات الصحيحة.
تعتمد طريقة فصل البروتينات على الاختلافات في وزنها الجزيئي:
A. جل الترشيح
ب. تنبيذ فائق
B. الرحلان الكهربائي للهلام بولي أكريلاميد D. كروماتوغرافيا التبادل الأيوني
D. تقارب اللوني
11. اختر الاجابة الصحيحة.
تعتمد طريقة فصل البروتينات على الاختلافات في قابليتها للذوبان في الماء:
أ. الترشيح الهلامي ب. التمليح
ب. كروماتوغرافيا التبادل الأيوني D. كروماتوغرافيا التقارب
E. بولي أكريلاميد الكهربائي للهلام
معايير الإجابات على "مهام التحكم الذاتي"
1. أ ، ب ، ج ، د
2. أ ، ب ، ج ، د
5. 1-B ، 2-A ، 3-G
6. 1-C ، 2-B ، 3-A
7. أ ، ب ، د ، د
8. 1-G ؛ 2-ب ، 3-ج
الشروط والمفاهيم الأساسية
1. البروتينات قليلة القسيمات ، البروتومر ، التركيب الرباعي للبروتينات
2. التغييرات التعاونية في التشكل البدائي
3. تأثير بوهر
4. تنظيم خيفي لوظائف البروتين ، مركز خيفي ومستجيب خيفي
5. المرافق الجزيئية ، بروتينات الصدمة الحرارية
6. عائلات البروتين (سيرين بروتياز ، غلوبولين مناعي)
7. IgM- ، G- ، E- ، A- اتصال الهيكل بالوظيفة
8. الشحنة الكلية للبروتينات ، نقطة متساوية الكهرباء للبروتينات
9. الكهربائي
10. التمليح
11. الترشيح الهلامي
12. كروماتوغرافيا التبادل الأيوني
13. تنبذ فائق
14. تقارب اللوني
15. الرحلان الكهربائي لبروتين البلازما
مهام العمل الرقابي
1. قارن تبعيات درجات تشبع الهيموغلوبين (Hb) والميوغلوبين (MB) بالأكسجين على ضغطه الجزئي في الأنسجة
 أرز. 1.34 اعتماد التشبع من MV وخضابالأكسجين من ضغطه الجزئي
أرز. 1.34 اعتماد التشبع من MV وخضابالأكسجين من ضغطه الجزئي
يرجى ملاحظة أن شكل منحنيات تشبع الأكسجين بالبروتين مختلف: للميوجلوبين - الغلو ، للهيموجلوبين - الشكل السيني.
1. قارن بين قيم الضغط الجزئي للأكسجين حيث يتم تشبع Mb و Hb بـ O 2 بنسبة 50٪. أي من هذه البروتينات له صلة أكبر بـ O 2؟
2. ما هي السمات الهيكلية لبروميد الميثيل التي تحدد تقاربها العالي مع O 2؟
3. ما هي السمات الهيكلية للهيموغلوبين التي تسمح لها بإفراز O 2 في الشعيرات الدموية لأنسجة الراحة (عند ضغط جزئي مرتفع نسبيًا لـ O 2) وزيادة هذا العائد في العضلات العاملة بشكل حاد؟ ما خاصية البروتينات قليلة القسيمات التي توفر هذا التأثير؟
4. احسب ما هي كمية O 2 (٪) التي تعطي الهيموجلوبين المؤكسج لعضلة الراحة والعمل؟
5. استخلاص استنتاجات حول العلاقة بين بنية البروتين ووظيفته.
2. تعتمد كمية الأكسجين التي يطلقها الهيموجلوبين في الشعيرات الدموية على شدة عمليات الهدم في الأنسجة (تأثير بوهر). كيف التغييرات في التمثيل الغذائي للأنسجة تنظم تقارب الهيموغلوبين لـ O 2؟ تأثير ثاني أكسيد الكربون و H + على تقارب الهيموغلوبين مع O 2
 1. وصف تأثير بوهر.
1. وصف تأثير بوهر.
2. في أي اتجاه تتدفق العملية الموضحة في الرسم التخطيطي:
أ) في الشعيرات الدموية في الرئتين ؛
ب) في الشعيرات الدموية الأنسجة؟
3. ما هي الأهمية الفسيولوجية لتأثير بوهر؟
4. لماذا يغير تفاعل الهيموغلوبين مع H + في المواقع البعيدة عن الهيم تقارب البروتين لـ O 2؟
3. تقارب الهيموغلوبين إلى O 2 يعتمد على تركيز الليجند الخاص به ، 2،3-بيفوسفوجليسيرات ، وهو منظم خيفي لتقارب الهيموغلوبين إلى O 2. لماذا يؤثر تفاعل يجند في موقع بعيد عن الموقع النشط على وظيفة البروتين؟ كيف ينظم 2،3-BPG تقارب Hb لـ O 2؟ لحل المشكلة أجب عن الأسئلة التالية:
1. من أين ومن ما يتم تصنيعه 2،3-ثنائي فوسفوجليسيرات (2،3-BPG)؟ اكتب صيغته ، وضح شحنة هذا الجزيء.
2. ما هو شكل الهيموجلوبين (أوكسي أو ديوكسي) الذي يتفاعل معه BPG ولماذا؟ في أي منطقة من جزيء Hb يحدث التفاعل؟
3. في أي اتجاه تستمر العملية الموضحة في الرسم التخطيطي؟
أ) في الشعيرات الدموية الأنسجة ؛
ب) في الشعيرات الدموية في الرئتين؟
4. حيث يجب أن يكون أعلى تركيز للمجمع
Nv-2،3-BFG:
أ) في الشعيرات الدموية للعضلات عند الراحة ،
ب) في الشعيرات الدموية للعضلات العاملة (بافتراض نفس تركيز BPG في كريات الدم الحمراء)؟
5. كيف ستتغير ألفة الهيموغلوبين بالأكسجين عندما يتكيف الشخص مع ظروف الارتفاع العالي ، إذا زاد تركيز BPG في كريات الدم الحمراء؟ ما هي الأهمية الفسيولوجية لهذه الظاهرة؟
4. يؤدي تدمير 2،3-BPG أثناء تخزين الدم المحفوظ إلى تعطيل وظائف Hb. كيف ستتغير ألفة الهيموغلوبين إلى O 2 في الدم المحفوظ إذا كان تركيز 2،3-BPG في كريات الدم الحمراء يمكن أن ينخفض من 8 إلى 0.5 مليمول / لتر. هل من الممكن نقل مثل هذا الدم للمرضى المصابين بأمراض خطيرة إذا تمت استعادة تركيز 2،3-BPG في موعد لا يتجاوز ثلاثة أيام؟ هل من الممكن استعادة وظائف كريات الدم الحمراء بإضافة 2،3-BPG إلى الدم؟
5. تذكر بنية أبسط جزيئات الغلوبولين المناعي. ما الدور الذي تلعبه الغلوبولين المناعي في جهاز المناعة؟ لماذا غالبًا ما يشار إلى Igs على أنها ثنائية التكافؤ؟ كيف ترتبط بنية Igs بوظائفها؟ (صِف باستخدام مثال لفئة من الغلوبولين المناعي.)
الخصائص الفيزيائية والكيميائية للبروتينات وطرق فصلها.
6. كيف تؤثر الشحنة الصافية للبروتين على قابليته للذوبان؟
أ) تحديد الشحنة الكلية للببتيد عند الرقم الهيدروجيني 7
علاء جلو تري برو اسب ليز سيس
ب) كيف ستتغير شحنة هذا الببتيد عند pH> 7 ، pH<7, рН <<7?
ج) ما هي النقطة المتساوية الكهربي للبروتين (IEP) وما هي البيئة التي تكمن فيها
IET من هذا الببتيد؟
د) ما هي قيمة الأس الهيدروجيني التي سيتم ملاحظة أقل قابلية للذوبان لهذا الببتيد.
7. لماذا يتخثر اللبن الرائب ، على عكس الحليب الطازج ، عند غليه (أي يترسب بروتين حليب الكازين)؟ جزيئات الكازين في الحليب الطازج لها شحنة سالبة.
8. يستخدم الترشيح الهلامي لفصل البروتينات الفردية. تم تحليل خليط يحتوي على بروتينات A و B و C بكتل جزيئية تساوي 160.000 و 80.000 و 60.000 ، على التوالي ، بواسطة ترشيح الهلام (الشكل 1.35). حبيبات الهلام المنتفخة قابلة للاختراق للبروتينات التي يقل وزنها الجزيئي عن 70000. ما هو المبدأ الذي تقوم عليه طريقة الفصل هذه؟ أي من الرسوم البيانية يمثل نتائج التجزئة بشكل صحيح؟ حدد ترتيب إطلاق البروتينات A و B و C من العمود.
 أرز. 1.35 استخدام طريقة الترشيح الهلامي لفصل البروتينات
أرز. 1.35 استخدام طريقة الترشيح الهلامي لفصل البروتينات
9. على التين. الشكل 1.36 ، يُظهر رسمًا تخطيطيًا للرحلان الكهربي على ورق البروتينات في مصل الدم لشخص سليم. الكميات النسبية لكسور البروتين التي تم الحصول عليها بهذه الطريقة هي: الألبومين 54-58٪ ، ألفا 1-غلوبولين 6-7٪ ، ألفا 2-غلوبولين 8-9٪ ، بيتا-غلوبولين 13٪ ، بيتا-جلوبيولين 11-12٪.
 أرز. 1.36 رحلان كهربائي على ورق لبروتينات بلازما الدم لشخص سليم (أ) ومريض (ب)
أرز. 1.36 رحلان كهربائي على ورق لبروتينات بلازما الدم لشخص سليم (أ) ومريض (ب)
أنا - γ- الجلوبيولين. II - β- الجلوبيولين ؛ ثالثا -α 2 - الجلوبيولين رابعا-α 2 - الجلوبيولين الخامس - الألبومين
تصاحب العديد من الأمراض تغيرات كمية في تكوين بروتينات مصل اللبن (خلل بروتين الدم). يتم أخذ طبيعة هذه التغييرات في الاعتبار عند إجراء التشخيص وتقييم شدة ومرحلة المرض.
باستخدام البيانات الواردة في الجدول. 1.5 ، قم بعمل افتراض حول المرض ، والذي يتميز بالمظهر الكهربي المعروض في الشكل. 1.36
الجدول 1.5. التغيرات في تركيز بروتينات مصل الدم في علم الأمراض
في الكيمياء غير العضوية
في أغلب الأحيان ، يحدث هذا الارتباط مع تكوين ما يسمى برابطة "التنسيق" بين المتبرع والمقبول ، حيث تعمل الروابط كقاعدة لويس ، أي أنها مانحة لزوج الإلكترون. عندما يتم ربط الروابط بالذرة المركزية ، فإن الخصائص الكيميائية للعامل المركب والروابط نفسها غالبًا ما تخضع لتغييرات كبيرة.
تسمية يجند
- الأول في اسم المركب في الحالة الاسمية هو الأنيون ، ثم في المضاف - الكاتيون
- باسم أيون معقد ، يتم سرد الروابط أولاً حسب الترتيب الأبجدي ، ثم الذرة المركزية
- تسمى الذرة المركزية في المجمعات الكاتيونية المحايدة الاسم الروسي ، وفي الأنيونات جذر الاسم اللاتيني مع اللاحقة "at". بعد اسم الذرة المركزية ، يشار إلى حالة الأكسدة.
- يُشار إلى عدد الروابط المرتبطة بالذرة المركزية بالبادئات "أحادية" ، "دي" ، "ثلاثة" ، "تترا" ، "بنتا" ، إلخ.
خصائص الترابط
الهيكل الإلكتروني
في الواقع ، أهم ما يميز اللجند ، والذي يسمح للفرد بتقييم والتنبؤ بقدرته على التكوين المعقد والتدمير الذاتي للمدار D - تدمير المركب ككل. في التقريب الأول ، يتضمن عدد أزواج الإلكترونات التي يمكن أن تخصصها الرابطة لإنشاء روابط التنسيق والقدرة الكهربية للذرة أو المجموعة الوظيفية المتبرعة.
الأسنان
يُطلق على عدد مواقع التنسيق للذرة المركزية (أو الذرات) التي يشغلها الترابط اسم denticity (من خطوط الطول. أوكار ، دنت - أسنان). يتم استدعاء الروابط التي تحتل موقع تنسيق واحد كثرة الوحيداتطب الأسنان (على سبيل المثال ، نح 3) ، اثنان - ثنائيةمسنن (أنيون أكسالات [ ا-C (= O) -C (= O) -أ] 2−). عادةً ما يُشار إلى الروابط التي يمكن أن تشغل عددًا أكبر من الأماكن على أنها بوليمسنن. على سبيل المثال ، حمض الإيثيلين أمينيتتراسيتيك (EDTA) ، والذي يمكن أن يشغل ستة مواقع تنسيق.
بالإضافة إلى اللزوجة ، هناك خاصية تعكس عدد ذرات الترابط المرتبطة بموقع تنسيق واحد للذرة المركزية. في الأدب الإنجليزي يُشار إليه بالكلمة سعادةولها تسمية تسمية مع ارتفاع المقابلة. على الرغم من أنها لا تملك على ما يبدو مصطلحًا راسخًا في اللغة الروسية ، إلا أنه في بعض المصادر يمكن للمرء أن يجد "haptness" في ورقة البحث عن المفقودين. على سبيل المثال ، يمكننا إعطاء ليجند سيكلوبنتاديينيل في مجمعات مركزية معدنية ، والتي تحتل موقع تنسيق واحد (أي أنها أحادية) ومرتبطة بجميع ذرات الكربون الخمس: η 5 - -.
طرق التنسيق

مركب مخلب EDTA 4−
يمكن أن تتشكل الأربطة التي تحتوي على أكثر من اثنتين من الأسنان مجمعات كلاب(غرام. χηλή - مخلب) - معقدات حيث يتم تضمين الذرة المركزية في دورة واحدة أو أكثر مع جزيء يجند. تسمى هذه الروابط مخلب. على سبيل المثال ، يمكننا الاستشهاد بمجمعات الكبريت من نفس EDTA ، مع ملاحظة أن العديد من روابط M-O الأربعة الموجودة فيها يمكن أن تكون رسميًا أيوني .
غالبًا ما يتم ملاحظته في تكوين مجمعات مخلبة تأثير كلاب- ثباتها أكبر مقارنة بالمجمعات المماثلة من الروابط غير المخلبة. يتم تحقيقه بسبب زيادة الحماية للذرة المركزية من التأثيرات المستبدلة وتأثير الانتروبيا. على سبيل المثال ، ثابت تفكك مركب الأمونيا للكادميوم 2+ يقل بحوالي 1500 مرة عن ثابت التفكك الذي يحتوي على إيثيلين ديامين 2+. والسبب في ذلك هو أنه عندما يتفاعل أيون الكادميوم المائي (II) مع إيثيلين ديامين ، فإن جزيئين من الترابط يحلان محل أربعة جزيئات ماء. في هذه الحالة ، يزداد عدد الجسيمات الحرة في النظام بشكل كبير ، ويزداد إنتروبيا النظام (ويزداد الترتيب الداخلي للمجمع وفقًا لذلك). وهذا يعني أن سبب تأثير كلاب هو زيادة في إنتروبيا النظام عندما يتم استبدال الروابط أحادية الطبقة بأخرى متعددة الأسطح ، ونتيجة لذلك ، انخفاض في طاقة جيبس.

دورة البورفيرين
يمكن أيضًا أن تكون الروابط عبارة عن جسور ، وتشكيل روابط بين الذرات المركزية المختلفة في مجمعات ثنائية أو متعددة النوى. يُشار إلى الروابط الموصلة بالحرف اليوناني μ ( مو).
ملحوظات
| الكيمياء الإنشائية | |
|---|---|
| الرابطة الكيميائية: | عطرية | الرابطة التساهمية | الرابطة الأيونية | وصلة معدنية | رابطة الهيدروجين | سند المانح المتقبل | Tautomerism | اتصال فان دير فال |
| عرض الهيكل: | |